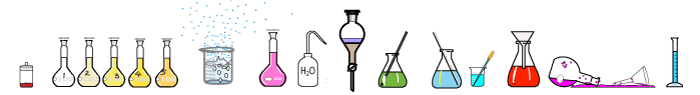Wat is een zuur? Wat is een base? Het principe is simpel... Je lost een zuur op in water en je krijgt H3O+ in de oplossing:
zuur + H2O → H3O+ + zwakke base
Je lost een base op in water en je krijgt OH- in de oplossing:
base + H2O → OH- + zwak zuur
Voeg je een zure oplossing bij een basische dan geven H3O+ en OH- samen weer water: H3O+ + OH- → 2 H2O
H3O+ = hydroniumion <-------------------------------------------> OH- = hydroxide-ionen

|
Zure stoffen ...
* zijn altijd goed oplosbaar in water,
* geven H+ aan het water,
* reageren met onedele metalen als Fe of Zn,
* reageren met marmer en andere steensoorten,
* lossen langzaam het glazuur van je tanden op.
|
Basische stoffen ...
* geven OH- in water,
* neutraliseren zuren,
* lossen (langzaam) koolhydraten op,
* lossen eiwitten op (glad gevoel aan je vingers!),
* tasten verf en laklagen langzaam aan.
|
pH
Als maat voor hoe zuur of basisch een oplossing is gebruiken we de pH: pH = -log[H3O+]
Moeilijk? Valt wel mee:
Als [H3O+] = 10-8 dan pH = 8
Als [H3O+] = 10-4 dan pH = 4
En als [H3O+] = 0,050? Pak je rekenmachine en tik in: 0.05 log Laat het min-teken weg, klaar: pH = 1,30
En als pH = 3,50 dan is [H3O+]? Pak je rekenmachine en tik in: 3.5 +/- 10x [H3O+] = 0,000316 of: 3,16 • 10-4
Sterke zuren geven bijna al hun protonen aan het water. Zwakke zuren geven een (klein) deel van hun protonen aan het water. Welk zuur is het sterkst welk het zwakst in de afbeelding?

De pH-schaal nog eens verduidelijkt met een animatie.
Koolzuur
Een heel bekend zwak zure oplossing in het dagelijks leven is "koolzuur". Als je op een terras water bestelt dan wordt gevraagd: "mét of zonder prik", "mit oder ohne Gaz", "plat of bruis" enzovoorts. "Prik" is het in het water opgelost CO2. Doordat het gas onder druk is opgelost komt het weer vrij bij het openen van de fles: het geeft bubbels in water, bier, champagne, enz. We zeggen: koolzuur.
CO2 reageert een beetje met water: CO2 + 2 H2O <--> HCO3- + H3O+ De pH wordt ongeveer 4.
Het is net alsof het zuur H2CO3 gereageerd heeft: H2CO3 + H2O <--> HCO3- + H3O+ Maar ... H2CO3 is geen stabiele stof: het bestaat niet echt.
Zeep
Een heel bekende zwakke base in het dagelijks leven is zeep. Gewone "natuurlijke zeep" wordt gemaakt uit plantaardige olie of vet en natrium- of kaliumhydroxide:
olie + natronloog ---> zeep + glycerol
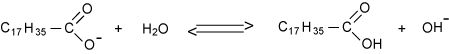
Na bereiding van de zeep kunnen er resten NaOH of KOH aanwezig zijn. Dan is de zeep sterk basisch en agressief (groene zeep). Zijn er juist resten olie over dan is de zeep zacht (babyzeep). Zeep is een zout van een vetzuur. Bijvoorbeeld natriumstearaat:

In water ontstaat een ion. Dit geeft met water een zwak basische reactie, de pH wordt ongeveer 10:
Ook in Wikipedia wordt e.e.a. goed uitgelegd: pH en pOH Ook de docent kan het goed uitleggen: berekenen van pH.
Spelen met een simulatie van zure en basische oplossingen kan hier.
En verder ...
Antwoord op de vraag over zuursterkte: B sterkste zuur, A het zwakste zuur. C zit daar dus tussen.