Koolwaterstoffen met een 'aromatisch karakter' zijn dus verbindingen met mesomerie van de π-bindingen in het molecuul. Hierdoor zijn deze verbindingen stabieler, dan zonder deze mesomerie. De meest bekende aromaat is benzeen. Deze stof verbaasde de chemici lange tijd omdat ondanks de dubbele bindingen, de stof niet reageert als een alkeen. In 1865 was het de chemicus Kékulé die benzeen als zesring voorstelde met drie dubbele bindingen.
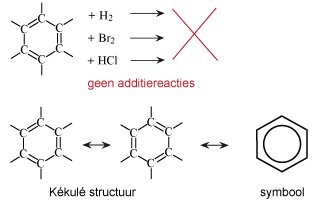 |
|
Aromaatringen komen in heel veel verbindingen voor. Dat de aromaten een slechte naam hebben komt voornamelijk doordat sommige vertegenwoordigers carcinogeen zijn gebleken. Het betreft vooral benzeen en sommige polycyclische aromaten (PAK's).
Benzeen, tolueen, xyleen.
Benzeen is bij kamertemperatuur een vloeistof. Een heel goed oplosmiddel voor heel veel (weinig polaire) stoffen: vetten, rubber, hars, lakken, verf, drukinkt en veel lijmsoorten. Benzeen wordt vooral gewonnen uit aardolie. Van benzeen is komen vast te staan dat het carcinogeen is. Benzeen verhoogt de kans op leukemie. Werknemers van bedrijven waar veel benzeen gebruikt werd bleken vaker leukemie te krijgen dan werknemers die daar niet aan waren blootgesteld. Hierdoor is benzeen in veel situaties (bijvoorbeeld in het onderwijs) wettelijk verboden. In plaats van benzeen wordt dan tolueen of xyleen gebruikt. Deze stoffen zijn minder schadelijk.
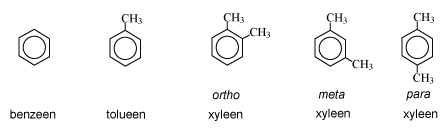
De chemische eigenschappen zijn grotendeels hetzelfde binnen deze groep van oplosmiddelen.
Als we de MAC-waarden vergelijken:
- benzeen 1 ppm
- tolueen 50 ppm
- xyleen 100 ppm
dan is wel duidelijk dat waar mogelijk de voorkeur gegeven wordt aan xyleen boven tolueen. Alle drie de stoffen zijn evengoed ongezond om langdurig in te ademen. 'Lijmsnuivers' die high willen worden van de inademing van tolueen of xyleen, lopen nier- en leverschade op. Hoe ongezond een stof is, is vaak moeilijk te bepalen. Er worden nu eenmaal geen experimenten gedaan met mensen als 'proefdieren'. Zo wordt de schadelijkheid van veel stoffen moeilijk echt vast te stellen.
De stoffen worden gebruikt voor de bereiding van veel producten. Voorbeelden hiervan zijn: fenol, TNT, synthetische rubber, polyester, kleurstoffen, wasmiddelen en weekmakers.
Mesomerie
Dat er verschillende elektronenstructuren mogelijk zijn binnen het molecuul, noemen we: mesomerie. Of ook wel: resonantie. Als er een substituent aan de benzeenring zit, dan kan deze substituent met de mesomerie meedoen. Daardoor veranderen de eigenschappen van de substituent. Als voorbeeld: fenol (hydroxybenzeen). De OH-groep gedraagt zich niet zo erg als alkanol-OH. De groep is zwak zuur. Dat komt weer doordat het anion dat ontstaat door gestabiliseerd is.
Elektrofiele substitutie
Aromaten geven dus geen elektrofiele addities. Bij zo'n additie zou de aromaat-eigenschap verdwijnen en dat kost energie. Een reactie-type dat wel gemakkelijk verloopt is de elektrofiele substitutie. Er is dan wel een elektrofiele aanval, maar deze leidt dan tot substitutie van een H-atoom.
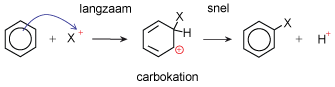
- De π-elektronen en een positief deeltje reageren.
- Er ontstaat een carbokation.
- Een H+ verlaat het molecuul en de aromaatring is weer hersteld.
Animatie bromering benzeen met AlBr3 als katalysator. Inclusief het energieschema.
Richtend effect substituent
Lastig onderwerp.
Als er een substituent in de benzeenring zit, heeft deze substituent invloed op de plaats waar een eventueel volgende substitutie plaats gaat vinden.
Misschien helpen de twee volgende, heel globale regels:
Ortho, para-richters
Een elktronenstuwer zoals: -OH, -OCH3, -NH2, -CH3 maakt het carbokation (intermediair) stabieler.
Dit effect is het sterkst als de + bij de eerste substituent zit. Dat is bij ortho-para substitutie van de 2e substituent.
Meta-richters
Een elktronenzuiger zoals: -CN, -CHO, -NH3+, -COOH -SO3H, -NO2 maakt het carbokation (intermediair) minder stabiel.
Dit effect is het sterkst als de + bij de eerste substituent zit. Dat is bij ortho-para substitutie van de 2e substituent.

