Naamgeving
Eerst nog even over de namen van anorganische stoffen. Voor de systematische naamgeving zijn de regels iets veranderd. De verandering staat nog niet in het boek omdat nog niet duidelijk is of het in de praktijk gebruikt zal worden. De bestaande namen blijven namelijk gewoon toegestaan en de nieuwe zijn lastiger in gebruik. Voor meer informatie: BINAS tabel 66G of klik hier.
Molecuulformules
Je kunt op verschillende manieren laten zien hoe een molecuul opgebouwd is. We hebben een 'molecuulformule', een 'elektronenformule' enzovoort. Als eenvoudig voorbeeld het watermolecuul:

Hoe zijn atomen aan elkaar gehecht?
Twee atomen kunnen - in hoofdzaak - op 2 manieren aan elkaar gebonden zijn:
Covalent Twee atomen delen een aantal elektronen: zij hebben dan een "bindend, gemeenschappelijk, elektronen paar".
Ionen Het ene atoom geeft een (of twee) elektronen aan het andere atoom, er ontstaan ionen die (aantrekking + en -) bij elkaar blijven.
In beide gevallen heeft het atoom een octed (8-omhulling van elektronen). We noemen dit: edelgasconfiguratie.
Covalent
Bijvoorbeeld de binding tussen twee chlooratomen, of de binding tussen twee zuurstofatomen:
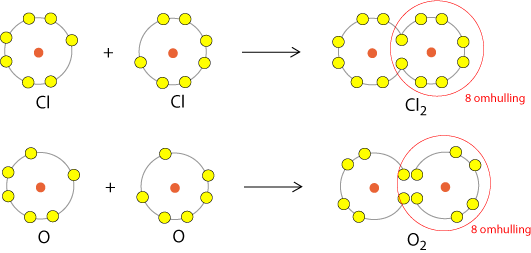
Chlooratomen vormen moleculen. Beide atomen in een molecuul delen een elektron met de ander. Zo heeft ieder atoom een octed (8-omhulling) aan elektronen. Zo is dat ook bij zuurstof. Nu delen de zuurstofatomen ieder 2 elektronen met de ander. Zo komen beide elementen (chloor en zuurstof) aan een stabiele toestand: de edelgasconfiguratie (8 elektronen in de buitenste schil).
Ionen
Atomen kunnen ook eenvoudig een elektron weggeven of krijgen en daardoor 8 omhulling bereiken. Als een atoom een elektron weggeeft wordt dat atoom een + ion. Het atoom dat het elektron ontvangt wordt een - ion.

Een atoom kan dus 8-omhulling krijgen door zich covalent te binden aan een zelfde soort atoom of door een elektron af te staan/op te nemen van een heel ander atoom. Tussen de uitersten: covalent of ionbinding, kan het atoom ook een polair covalente binding aangaan. De atomen delen dan wel hun bindende elektronen maar zij worden niet ion. Zo zijn heel veel covalente bindingen polair. Als twee atomen dezelfde EN-waarde hebben dan is de binding zuiver covalent. Hebben twee atomen een verschil in EN-waarde van groter dan 2, dan zal er eerder een ionbinding ontstaan. Is er wel verschil in EN-waarde maar niet zo groot, dan is de binding polair. (Voor EN-waarden zie het periodiek systeem.):
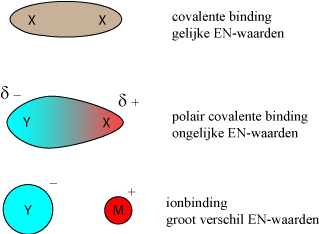
Heeft een stof polaire moleculen dan klitten de moleculen sterker aan elkaar. De stof heeft dan een hoger kookpunt dan zonder die polariteit. Zijn er ook nog H-bruggen zoals in water dan klitten de moleculen nog sterker aan elkaar. In water bewegen de moleculen willekeurig door elkaar. (Linker afbeelding hieronder). De moleculen hebben af en toe één of meer H-bruggen. In ijs hebben de watermoleculen ieder 4 H-bruggen en is er een vaste kristalstructuur (Rechter afbeelding hieronder).

Speelse animaties om een en ander te verduidelijken: vorm van het molecuul en dipoolmolecuul.
En verder..
En nog verder ....
Een binding heeft een elektronenpaar tussen de atomen. Veel moleculen hebben dubbele bindingen tussen twee atomen.
Hoe moeten we ons dat voorstellen?