Zuren en basen zijn belangrijke stoffen. Als zij in water opgelost zijn bepalen zij de pH van de oplossing. Sterke zuren geven alle hun protonen aan het water en er ontstaat H3O+. Een zwak zuur geeft niet al zijn protonen aan het water. Er ontstaat een evenwicht:
|
Is HB het zuur en B- de bijbehorende base,
dan is het evenwicht met water:
|
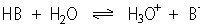 |
|
En de evenwichtsvoorwaarde:
|
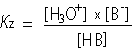 |
In de volgende animatie kun je een oplossing kiezen en zien hoe de concentraties veranderen. Als symbool voor het zuur is hier HA gebruikt. In de pagina "eigen oplossing" kun je concentratie en zuursterkte instellen. Kijk wat dat doet. Merk op dat de zuurconcentratie van een zwak zuur behoorlijk constant is (lijkt). Zuur-base-oplossingen.
In het geval van een zwak zuur splitsen er maar weinig protonen af. De zuurconcentratie [HB] is daardoor bijna even groot als de concentratie opgelost zuur: cz. We mogen daarom in de evenwichtsvoorwaarde [HB] vervangen door de opgeloste hoeveelheid zuur: cz. De formule verandert dan. [H3O+] en dus pH kun je nu eenvoudig berekenen met:
![]()
Het zelfde verhaal voor zwakke basen, [OH-] en dus pOH en dus pH zijn goed te berekenen met:
Deze formule is goed bruikbaar zolang [OH-] veel kleiner is dan cb
Buffer
Voeg je aan water een zwak zuur toe (HB) en ook de geconjugeerde zwakke base (B-) dan ontstaat een 'buffer'. Een zuur/base-buffer houdt de pH (bijna) constant bij verdunnen en toevoegen van kleine hoeveelheden sterk zuur of base. In de 'animatie buffer' zie je wat er gebeurt als er sterk zuur of sterke base wordt toevoegd aan een azijnzuurbuffer. De uitleg is in het Engels. animatie buffer
In de evenwichtsvoorwaarde mogen we voor [B-] de hoeveelheid base invullen en voor [HB] de hoeveelheid zuur. In mol of mmol. Beide in dezelfde eenheid. Zo ontstaat
de 'bufferformule':
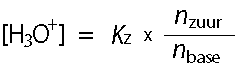
Aan de formule is te zien dat bij gelijke hoeveelheden zuur en base de hydroniumionen-concentratie gelijk is aan de Kz. En dus: pH = pKz.
Nu kun je ook begrijpen en voorspellen hoe titratiecurven van zwakke zuren (of die van zwakke basen) er uit zien.
En verder...