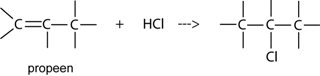Vaak is er in een molecuul een dubbele binding. Dat wil zeggen dat er niet één gemeenschappelijk elektronenpaar is maar twee paren zijn. Bijvoorbeeld het zuurstofmolecuul. Twee zuurstofatomen verbonden door een dubbele binding. Dat zijn twee elektronenparen. Deze bindingen zijn niet aan elkaar gelijk. Een van de elektronenparen is minder stabiel dan de andere. De meer stabiele binding noemen we een σ-binding.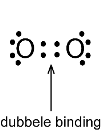 Een sigma-binding.
Een sigma-binding.
De σ-binding is de dezelfde als in een enkele binding.
Het andere elektronenpaar is minder stabiel. We noemen dit een pi-binding. Een π-binding.
Een molecuul met een drievoudige binding zoals stikstof, heeft één σ- en twee π-bindingen.
Dat is in het algemeen zo: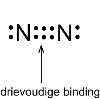
enkele binding: één σ-binding
dubbele binding: één σ-binding en één π-binding
drievoudige binding: één σ-binding en twee π-bindingen
De dubbele binding bestaat dus uit een σ- en een π-binding. De σ-binding heeft zijn elektronenpaar tussen de atoo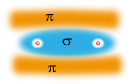 mkernen in. Een molecuulbaan tussen de atoomkernen. De elektronen vann de π-binding bevinden zich langs de σ-binding. Je zou kunnen zeggen: meer aan de buitenkant van het molecuul.
mkernen in. Een molecuulbaan tussen de atoomkernen. De elektronen vann de π-binding bevinden zich langs de σ-binding. Je zou kunnen zeggen: meer aan de buitenkant van het molecuul.
Bij een drievoudige binding zijn er dus twee π-bindingen. Deze π-elektronen zitten aan de buitenkant.
Je kunt je voorstellen dat deze elektronen een minder stabiele binding geven. Dus: veel gemakkelijker met andere stoffen reageren. 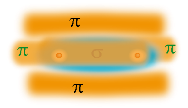
Moleculen met dubbele of drievoudige bindingen heten daarom: onverzadigd. Ze kunnen nog reageren.
Onverzadigde verbindingen vertonen additiereacties. Zo een additiereactie is bijvoorbeeld de reactie van propeen met HCl. HCl wordt geaddeerd aan propeen. De dubbele binding verdwijnt.
Het zijn dus de π-elektronen die reageren: