Startpagina mlochemie
Sterkte van een alkaanzuur
Zuursterkte.... hoe zat dat ook al weer?
De carbonzuurgroep kan dus een proton (H+) afsplitsen. Omdat water het meest voorkomende oplosmiddel is kijken we bijna altijd naar de zuursterkte in water. Het zuur geeft een H+ aan het water. Er ontstaan hydroniumionen (H3O+). Komen er veel H3O+ ionen dan noemen we het zuur 'sterk' komen er weinig dan noemen we het zuur 'zwak'.
Carbonzuren (alkaanzuren) zijn zwakke zuren. Hoeveel H3O+ ionen zij afsplitsen wordt bepaald door het 'protolyse evenwicht'.

In de vergelijking is HB het zuur en 'B' de zuurrest.
Vergelijking 1 laat zien hoe de concentraties met elkaar samenhangen. Hierbij heeft Kz (de evenwichtsconstante of hier: protolyseconstante) een vaste waarde.
Bij alkaanzuren mag je in plaats van de HB-concentratie ook de cz invullen. Met de cz bedoelen we de hoeveelheid zuur in mol per liter die in de oplossing is gebracht. Omdat zwakke zuren maar heel weinig splitsen is [HB] vrijwel gelijk aan cz.
Voor de 'gewone' alkaanzuren is de Kz-waarde in de orde van 0,0001. Bijvoorbeeld:
methaanzuur Kz = 1,6 x 10-4 ethaanzuur Kz = 1,7 x 10-5 propaanzuur Kz = 1,3 x 10-5
Maar... met elektronegatieve substituenten in het molecuul neemt de zuursterkte toe: trichloorethaanzuur Kz = 0,2 !
Hoe dichter de substituent bij de carboxylgroep zit des te sterker het effect.
Zuursterkte kan ook worden uitgedrukt in de negatieve logaritme van de Kz. Dit noemen we de pKz. Bijvoorbeeld:
methaanzuur pKz = 3,79 ethaanzuur pKz = 4,77 propaanzuur pKz = 4,88
Hoe sterker het zuur des te groter de Kz en des te kleiner de pKz.
Meer uitgebreide uitleg: 'Basischemie voor het MLO' hoofdstuk 20 Zuur- en base-evenwichten.
Een alkaanzuur is een alkaan met een carbonzuurgroep. Het waterstofatoom kan als positief ion (proton) loslaten. Wat overblijft noemen we de

'zuurrest'. Carbonzuren zijn zwakke zuren met een protolyseconstante in de orde van 0,00001. Maar wel weer sterk genoeg om waterige oplossingen zuur te maken. Denk maar aan azijn.
- Hoe langer de alkaanketen, des te zwakker het zuur.
- Een of meer elektronenzuigers (elektronegatieve substituenten) verhogen de zuursterkte.
Het allerbekendste alkaanzuur is natuurlijk azijnzuur (ethaanzuur). Gewone consumptie-azijn bevat 4% ethaanzuur. Schoonmaakazijn 10%.
De iets langere alkaanzuren zoals propionzuur (propaanzuur), boterzuur (butaanzuur) en valeriaanzuur (pentaanzuur) zijn onaangenaam ruikende stoffen (kaas, zweet, mest...). Ze komen evengoed veel in allerlei voedingsmiddelen voor. Veelal als vetzuur, dat wil zeggen: in een esterbinding met glycerol. In botervet is bijvooorbeeld boterzuur aanwezig.
Niet alleen in vetten, maar ook in andere esters vinden we deze zuren terug. Geur- en smaakstoffen!
Citroenzuur 
Een ander heel veel voorkomend organisch zuur is citroenzuur. Of officieel: '2-hydroxypropaan-1,2,3-tricarbonzuur'. Ook aangeduid met zijn E-nummer: E 330. Citroenzuur zit in alle fruitsoorten. Maar eigenlijk ook in alle andere voedingsmiddelen. Het metabolisme in plantaardige én dierlijke cellen verloopt ook via citroenzuur.(Citroenzuurcyclus.)
 Een aardige toepassing van citroenzuur is de bruistablet. En bruistablet is een pil met een medicijn daarin. Tevens is vast citroenzuur en natriumwaterstofcarbonaat toevoegt. Als je de tablet in contact brengt met water dan lost het zuur op en reageert met water en vervolgens met het waterstofcarbonaat:
Een aardige toepassing van citroenzuur is de bruistablet. En bruistablet is een pil met een medicijn daarin. Tevens is vast citroenzuur en natriumwaterstofcarbonaat toevoegt. Als je de tablet in contact brengt met water dan lost het zuur op en reageert met water en vervolgens met het waterstofcarbonaat:
H3O+ + HCO3- → 2 H2O + CO2(g)
Er ontwijkt koolstofdioxide-gas, het tablet wordt als het ware opgeblazen en het medicijn wordt in water verdeeld.
Bereiding
Hoe maak je een carbonzuur in het laboratorium? Hieronder een beknopt overzicht van uitgangsstoffen en reactietype:

Zou je van elke methode de globale reactie kunnen geven?
Jammer. Zie hoofdstuk 9: 9.4 Synthese van alkaanzuren.
Wat kun je ermee?
Dat wil zeggen: wat kun je er van maken? Wat zijn de chemische eigenschappen? Er zijn natuurlijk meer mogelijke producten dan hieronder genoemd. Maar dit zijn wel de belangrijkste (meest voorkomend). Een carbonzuur, daarvan kun je maken een:

De vraag is wel weer: hoe dan?
Esters
Een ester ontstaat uit een carbonzuur en een alkanol.
De kleinere esters zijn kleurloze vloeistoffen. Weinig oplosbaar in water. Maar voldoende oplosbaar om een fruitig smaakje aan het water te geven. Esters zijn dan ook belangrijke smaakstoffen in fruit.
Maar esters worden ook gebruikt als oplosmiddelen in bijvoorbeeld lijm of verf.
Voor wie het allemaal nog best lastig vindt. De leraar Sieger Kooy legt het nog eens uit.
Esters van glycerol zijn oliën of vetten. De carbonzuren die in deze glycerolesters zitten noemen we 'vetzuren'. Dit kunnen vetzuren met korte ketens zijn. Denk maar aan butaanzuur (boterzuur), maar veel vetzuren hebben een lange keten: c-16, C-18, C-20, steeds een even aantal C-atomen. De onverzadigde vetzuren zijn belangrijk voor de gezondheid. Vetten vormen na hydrolyse met NaOH of KOH mengsels van glycerol en vetzure zouten. Een vetzuur zout is een zeep. De hydrolyse van een vet noemen we dan ook: 'verzepen'.
Aldehyden en ketonen, je kunt ook zeggen "carbonyl-verbindingen". Want een dubbelgebonden zuurstofatoom op een koolstofatoom is een carbonylgroep. Zit de carbonyl aan het einde van de keten, dan is het een aldehyde. Op het koolstof zit dan nog een waterstofatoom. De groep is nog oxideerbaar. Zit de carbonyl in de keten, dus op een secundaire C, dan is het een keton.
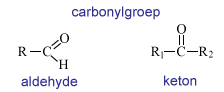
Aceton
(Propanon) en MEK (methylethylketon) zijn oplosmiddelen voor heel veel organische stoffen. Het molecuul heeft een sterke dipool maar ook alkylgroepen. Apolaire stoffen lossen ook vaak goed op in dit type ketonen. Het zijn oplosmiddelen voor verf, lak, nagellak, lijmen, kunststoffen enzovoort.
Formaldehyde
Formaldehyde (methanal) is net als aceetaldehyde (ethanal) een behoorlijk reactieve stof. Reageert dus gemakkelijk. Polymeriseert gemakkelijk. Methanal vormt bijvoorbeeld 'paraformaldehyde'. Een witte vaste stof die wel gebruikt wordt als brandstof bij het kamperen. In de plaats van spriritus. Maar polymeren ontstaan ook met fenolen en eiwitten. Doordat formaldehyde reageert met eiwitten wordt het gebruikt als "sterk water". Organen van dieren en mensen kunnen in een formaline-oplossing worden bewaard voor verder onderzoek. Er komen dan "cross links" tussen de eiwitmoleculen. Het eiwit blijft min of meer zijn vorm houden, maar verliest wel zijn functie. Methanal wordt daarom ook gebruikt om te desinfecteren. Vermoedelijk kankerverwekkend.
Smaak- en geurstoffen
Grotere moleculen met een aldehyde- of keton-groep hebben weer heel andere eigenschappen. Vaak geurige stoffen die in de natuur veel voorkomen en bijdragen aan de geuren en smaken van allerlei producten.
Suikers
In principe hebben koolhydraten altijd of een aldehyde-groep of een ketongroep. Weliswaar verdwijnt de dubbelgebonden O vaak door ringsluiting in het suikermolecuul.
Voorbeelden:

- oxidatie van een alkanol
- ozonolyse van een alkeen
- reductie van een zuurchloride
- acylering van een aromaat
-
acetaalvorming met een alkanol
-
additie van HCN
-
additie van een ammoniak-afgeleide ( geeft: oxim, hydrazon, fenylhydrazon)
-
reductie tot alkanol
-
oxidatie tot alkaanzuur (alleen aldehyde)
-
additie van een grignardverbinding
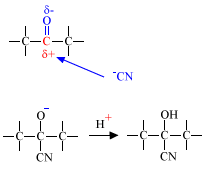
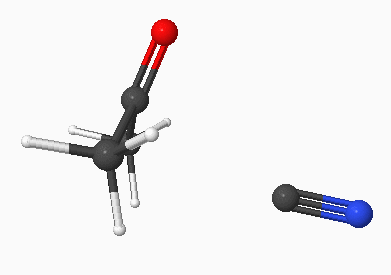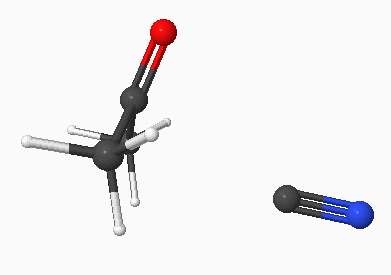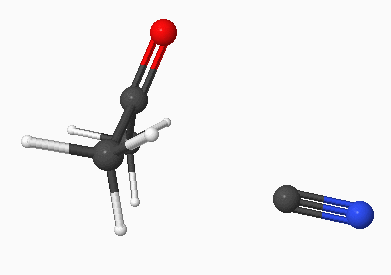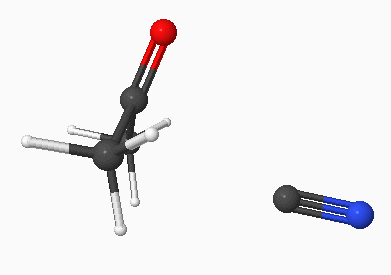
De meeste reacties van carbonylverbindingen zijn addities. Er is immers een dubbele binding! Het is nu niet een elektrofiele additie zoals bij een alkeen, maar een nucleofiele additie. De reactie verloopt doordat een negatief (nucleofiel) deeltje aanvalt op het positieve koolstofatoom.
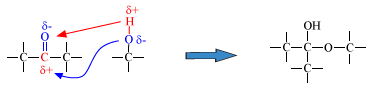
Of bij de cyanohydrine synthese (additie HCN):
 |
 |
Zit er in het molecuul van een koolwaterstof een OH-groep, dan hebben we te maken met een alkanol. De naam wordt dan die van de alkaan met als uitgang: -ol. Dus methanol, ethanol, propanol enzovoort. De plaats van de OH-groep wordt weer met een nummer aangegeven. Dit nummer kiezen we zo laag mogelijk. In de systematische naam die de voorkeur heeft van de IUPAC (International Union of Pure and Applied Chemistry) komt het plaatsnummer direct voor de uitgang -ol. Dus: propaan-1-ol, propaan-2-ol, pentaan-1-ol, pentaan-2-ol, pentaan-3-ol enzovoort. Lange tijd werd het plaatsnummer voor de naam gezet: 2-propanol, 1-pentanol en dergelijke. Dit is strikt genomen ook niet fout en je zal deze aanduiding ook nog veel tegenkomen. Maar... de PIN (Preferred IUPAC Name) is dus het nummer direct voor de uitgang -ol.
Is er een functionele groep in het molecuul met een 'hogere prioriteit', dan noemen we de OH-groep vóór de hoofdnaam met 'hydroxy'. Bijvoorbeeld:
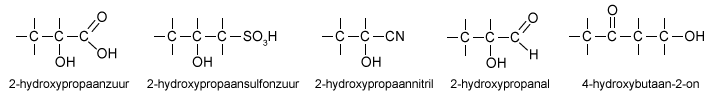

De waterstofbrug is een heel bijzondere binding...
Ode aan de H-brug

- ijs heeft een lagere dichtheid dan water, daardoor drijft ijs op water, het leven gaat onder het ijs gewoon door, de meeste andere stoffen zetten juist uit als ze smelten, ijs dus niet
- ijs heeft een hele hoge smeltwarmte
H-brug: de leraar legt het uit
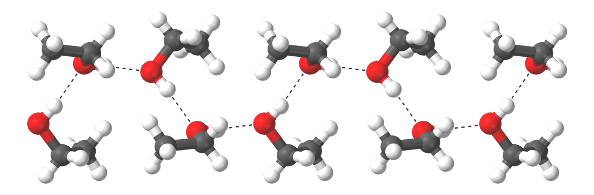
Koolhydraten zoals zuiker, cellulose of zetmeel hebben veel OH-groepen in het molecuul en vormen daardoor ook H-bruggen. Cellulose (materiaal waar papier van gemaakt is) bijvoorbeeld bestaat uit strengen glucose-moleculen die elkaar weer met H-bruggen vasthouden. Papier wordt met heet water een papje. Je maakt dan de H-bruggen los. (Lees meer in hoofdstuk 12.) In de tekening zijn de H-bruggen blauw:

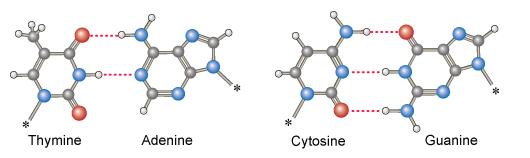
De H-brug is voor het leven op aarde eigenlijk de meest belangrijke chemische binding die er is. Dit inzicht heeft de H20-sisters geïnspireerd tot een dansje en liedje.
Hoe maakt de chemicus een alkanol?
Zie bladzijde 161 voor een selectie van methoden... Hier, uiterst compact:
- additie water aan alkeen
- additie water aan epoxide
- reductie ester, aldehyde of keton
- additie Grignard aan carbonyl
- verzeping ester
Chemische eigenschappen
Van een alkanol kun je weer maken: alkeen, halogeenalkaan, ester, ether, aldehyde, keton, alkaanzuur....
Speciale aandacht hier voor de partiële oxidatie. Een alkanol is met milde oxidatiemiddelen te oxideren zolang als er nog waterstofatomen aan het koolstofatoom zitten. Het koolstofatoom van de OH-groep welteverstaan.