Startpagina mlochemie

Bereiding
De vraag is weer: hoe maak je ze?
De chemische bereidingswijzen staan verspreid in het hoofdstuk. Van alle mogelijke syntheses, worden de belangrijkste genoemd.
Kjeldahl
Stikstof komt - in natuurlijke stoffen - veel voor in anorganische verbindingen. Denk aan stikstof in de lucht, nitraten, ammoniumzouten enz. Maar ook in - natuurlijke - organische verbindingen. We spreken over: 'organisch gebonden stikstof'. Voor veel organismen (dierenrijk) moet stikstof in de voeding aanwezig zijn. Je komt daarom de meting van het 'totaal organisch gebonden stikstof' veel tegen. Methoden volgens Kjeldahl of volgens Dumas. Kjeldahl is de meest toegepaste analyse.
De Kjeldahl analyse verloopt in drie stappen:
- Destructie.
Het monster wordt verhit tot 400 oC met geconcentreerd zwavelzuur en een katalysator (Cu2+). Tijdens deze destructie wordt alle stikstof omgezet tot ammonium. - Destillatie.
Na omzetting van de sterk zure naar een sterk basische oplossing. Door toevoegen van geconcentreerde natronloog wordt de oplossing basisch en ontwijkt het ammonium als NH3-gas. Na enige tijd destilleren is alle ammoniak kwantitatief overgebracht naar een oplossing van verdund zuur. De stikstof is nu weer aanwezig als ammonium-ion. - Meting.
Afhankelijk van de opvangvloeistof (verdund zoutzuur, verdund boorzuur) wordt de opgevangen ammoniak teruggetitreerd, of direct getitreerd in geval van boorzuur. Ook kan de ammoniumconcentratie spectrometrisch bepaald worden.

TNT
Verbindingen met nitrogroepen zijn vaak explosief. Bekend voorbeeld is trinitrotouleen (TNT). Trinitrotolueen is explosief doordat er bij uiteenvallen van de stof veel gassen onstaan en doordat de stof veel chemische energie verliest en dus meer stabiele producten levert. Je zou kunnen zeggen: vergelijkbaar met een verbranding maar de benodigde zuurstof zit al in de explosieve stof.
Globale reactie bij de explosie van TNT:
2 C7H5N3O6 (s) ----> 3 N2 (g) + 7 CO (g) + 5 H2O (g) + 7 C (s)
TNT is een maat voor explosieve kracht geworden. Grote explosies worden uitgedrukt in "ton TNT".
Een ander bekend voorbeeld is glyceroltrinitraat. Dat dus eigenlijk geen nitroverbinding is. Toch wordt glyceroltrinitraat meestal 'nitroglycerine' genoemd. Glyceroltrinitraat opgenomen in poreus "kiezelgoer" staat bekend als dynamiet
Azokleurstoffen
Laat je aniline (aminobenzeen) reageren met verdund salpeterigzuur, dan ontstaat een diazoniumzout. De reactie wordt gekoeld uitgevoerd, omdat bij verwarmen het gemakkelijk misgaat: er ontstaat dan een teerachtige substantie.
Dit diazoniumzout kan gemakkelijk reageren met andere aromaten. Vooral als daar al een hydroxygroep of aminogroep in de benzeenring aanwezig is. Er ontstaat dan een azokleurstof. Azokleurstoffen worden ook in onze voeding toegepast.
Koolhydraten zijn koolwaterstoffen met een carbonylgroep en OH-groepen. De chemische reacties zijn dan ook gelijk aan die van de alkanolen, aldehyden en ketonen. Toch zijn de 'gewone' chemische eigenschappen niet zo heel belangrijk. Koolhydraten komen in de natuur veel voor en zijn belangrijk omdat zij deel uitmaken van ons voedsel. En ook omdat er veel - natuurlijke - producten mee gemaakt worden: katoen, hout, papier. Het onderwerp 'koolhydraten' is vooral lastig omdat er zoveel verschillende exemplaren van zijn.
Aldohexosen
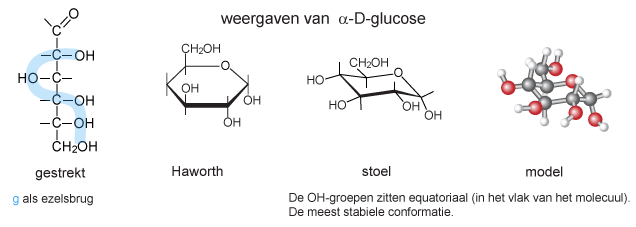
Laten we daarom nog eens goed kijken naar de belangrijkste koolhydraat: glucose. Brutoformule: C6H12O6. Voor deze brutoformule kunnen we 16 stereo-isomeren noteren. De 8 belangrijkste staan in onderstaand schema. Een sterretje bij een C-atoom betekent: asymmetrisch. Met 4 asymmetrische C-atomen zijn er: 24 = 16 isomeren. Dat er maar 8 zijn afgebeeld komt doordat we het rode sterretje nog niet hebben meegerekend. En 23 = 8. De structuren zijn afgebeeld in de Fischerprojectie. Omdat aan het onderste asymmetrische C-atoom (rode sterretje) de OH-groep naar rechts zit, krijgt elke naam een D als voorvoegsel. Deze groep van 8 vormen de aldohexosen. Aldo van 'aldehyde' en hexose van: 6 C-atomen.
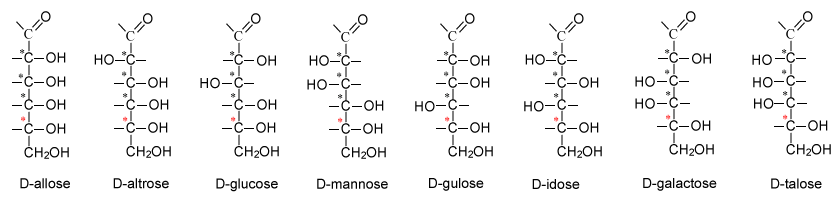
Glucose
Elke aldohexose heeft een eigen naam: allose, altrose, glucose enz. Van elke structuur in dit schema is er theoretisch nog een spiegelbeeld. Dit spiegelbeeld krijgt een L voor de naam, omdat de OH-groep van de C nummer 5 - de C met de rode ster - nu links zit. Van D-glucose bestaan in gestrekte structuur dus 2 stereo-isomeren: D-glucose en L-glucose. De gestrekte structuur is niet de vorm waarin de hoolhydraat zich veel laat zien. Hexosen vormen cyclische verbindingen door middel van een halfacetaal-binding. Dit kan op 2 manieren: de OH-groep die eerst van de aldehydegroep was, steekt omlaag of omhoog. Omlaag: α-D-glucose, omhoog: β-D-glucose.
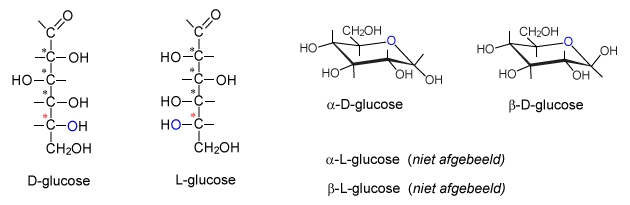
Mogelijk zijn dus: α-D-glucose, α-L-glucose, β-D-glucose en β-L-glucose.Het zijn de D-suikers die in de natuur voorkomen. α-D-glucose kost bij een chemicaliënhandel 30 tot 80 euro per 1000 g, afhankelijk van de zuiverheid. β-D-glucose kost ruim 100 euro voor slechts 1 gram! L-glucose is ruwweg 2000 maal zo duur als D-glucose. Dit komt doordat L-glucose in het laboratorium gesynthetiseerd moet worden, terwijl D-glucose uit talloze bronnen gewonnen kan worden (honing, bietsuiker, rietsuiker).
Van belang is dus D-glucose.
Uit waterige oplossing gekristalliseerde glucose is α-D-glucose. De witte vaste stof wordt in het dagelijks leven aangeduid als: 'druivensuiker'. In water opgelost hebben we: 36% α-D-glucose en 64% β-D-glucose. Slechts ongeveer 0,02% is in gestrekte vorm opgelost.
De drie structuren zijn wel met elkaar in evenwicht:
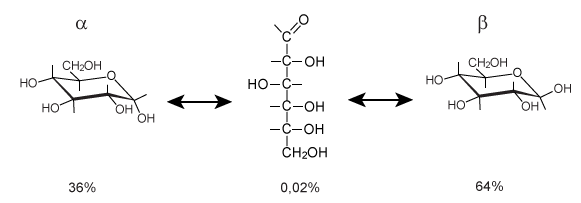
Los je vast α-D-glucose op in water, dan begin je met 100% α-D-glucose. Het evenwicht stelt zich langzaam in. Met een polarimeter kun je de draaiing van gepolariseerd licht meten. Van een verse glucose-oplossing zie je de draaiingshoek langzaam veranderen. De draaiing is pas na enkele uren constant. Deze verandering van draaiing is bekend onder de naam 'mutarotatie'.
Glucose wordt - net als de andere monosacchariden - op verschillende manieren weergegeven:
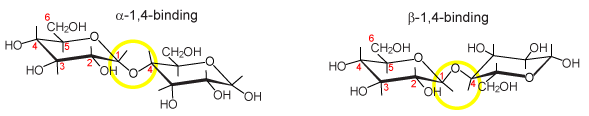
Bij koppeling van monosacchariden tot disacchariden of polysacchariden zijn de eenheden via C-1 en C-4 met elkaar verbonden. α of β. Zie weer glucose als voorbeeld:
Reducerende suikers
Aantoningsreacties op suikers zijn vaak gebaseerd op het reducerend vermogen van de aldehyde-groep. Een aldose is dus een reducerende suiker. Maar in basisch milieu zijn ketosen dat ook. In basisch milieu is er namelijk het evenwicht tussen de keton-groep, enol-groep en aldehyde-groep.
Ook sommige disacchariden zijn reducerend (maltose en lactose) doordat de halfacetaal van de glucose-ring open kan en dan oxideerbaar is.
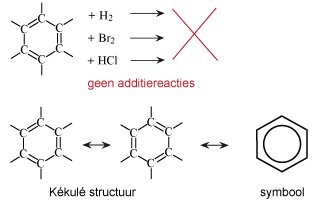
Koolwaterstoffen met een 'aromatisch karakter' zijn dus verbindingen met mesomerie van de π-bindingen in het molecuul. Hierdoor zijn deze verbindingen stabieler, dan zonder deze mesomerie. De meest bekende aromaat is benzeen. Deze stof verbaasde de chemici lange tijd omdat ondanks de dubbele bindingen, de stof niet reageert als een alkeen. In 1865 was het de chemicus Kékulé die benzeen als zesring voorstelde met drie dubbele bindingen.
 |
|
Aromaatringen komen in heel veel verbindingen voor. Dat de aromaten een slechte naam hebben komt voornamelijk doordat sommige vertegenwoordigers carcinogeen zijn gebleken. Het betreft vooral benzeen en sommige polycyclische aromaten (PAK's).
Benzeen, tolueen, xyleen.
Benzeen is bij kamertemperatuur een vloeistof. Een heel goed oplosmiddel voor heel veel (weinig polaire) stoffen: vetten, rubber, hars, lakken, verf, drukinkt en veel lijmsoorten. Benzeen wordt vooral gewonnen uit aardolie. Van benzeen is komen vast te staan dat het carcinogeen is. Benzeen verhoogt de kans op leukemie. Werknemers van bedrijven waar veel benzeen gebruikt werd bleken vaker leukemie te krijgen dan werknemers die daar niet aan waren blootgesteld. Hierdoor is benzeen in veel situaties (bijvoorbeeld in het onderwijs) wettelijk verboden. In plaats van benzeen wordt dan tolueen of xyleen gebruikt. Deze stoffen zijn minder schadelijk.
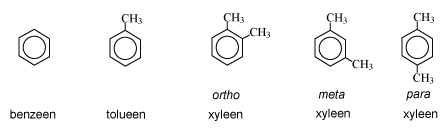
De chemische eigenschappen zijn grotendeels hetzelfde binnen deze groep van oplosmiddelen.
Als we de MAC-waarden vergelijken:
- benzeen 1 ppm
- tolueen 50 ppm
- xyleen 100 ppm
dan is wel duidelijk dat waar mogelijk de voorkeur gegeven wordt aan xyleen boven tolueen. Alle drie de stoffen zijn evengoed ongezond om langdurig in te ademen. 'Lijmsnuivers' die high willen worden van de inademing van tolueen of xyleen, lopen nier- en leverschade op. Hoe ongezond een stof is, is vaak moeilijk te bepalen. Er worden nu eenmaal geen experimenten gedaan met mensen als 'proefdieren'. Zo wordt de schadelijkheid van veel stoffen moeilijk echt vast te stellen.
De stoffen worden gebruikt voor de bereiding van veel producten. Voorbeelden hiervan zijn: fenol, TNT, synthetische rubber, polyester, kleurstoffen, wasmiddelen en weekmakers.
Mesomerie
Dat er verschillende elektronenstructuren mogelijk zijn binnen het molecuul, noemen we: mesomerie. Of ook wel: resonantie. Als er een substituent aan de benzeenring zit, dan kan deze substituent met de mesomerie meedoen. Daardoor veranderen de eigenschappen van de substituent. Als voorbeeld: fenol (hydroxybenzeen). De OH-groep gedraagt zich niet zo erg als alkanol-OH. De groep is zwak zuur. Dat komt weer doordat het anion dat ontstaat door gestabiliseerd is.
Elektrofiele substitutie
Aromaten geven dus geen elektrofiele addities. Bij zo'n additie zou de aromaat-eigenschap verdwijnen en dat kost energie. Een reactie-type dat wel gemakkelijk verloopt is de elektrofiele substitutie. Er is dan wel een elektrofiele aanval, maar deze leidt dan tot substitutie van een H-atoom.
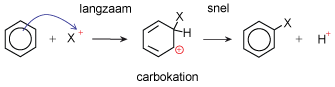
- De π-elektronen en een positief deeltje reageren.
- Er ontstaat een carbokation.
- Een H+ verlaat het molecuul en de aromaatring is weer hersteld.
Animatie bromering benzeen met AlBr3 als katalysator. Inclusief het energieschema.
Richtend effect substituent
Lastig onderwerp.
Als er een substituent in de benzeenring zit, heeft deze substituent invloed op de plaats waar een eventueel volgende substitutie plaats gaat vinden.
Misschien helpen de twee volgende, heel globale regels:
Ortho, para-richters
Een elktronenstuwer zoals: -OH, -OCH3, -NH2, -CH3 maakt het carbokation (intermediair) stabieler.
Dit effect is het sterkst als de + bij de eerste substituent zit. Dat is bij ortho-para substitutie van de 2e substituent.
Meta-richters
Een elktronenzuiger zoals: -CN, -CHO, -NH3+, -COOH -SO3H, -NO2 maakt het carbokation (intermediair) minder stabiel.
Dit effect is het sterkst als de + bij de eerste substituent zit. Dat is bij ortho-para substitutie van de 2e substituent.

Ethers zijn verbindingen met moleculen die op op die van water lijken. Vervang in water allebei de H-atomen en je hebt een ether. De ethers met kleine alkylgroepen (C-1, C-2, C-3, C-4 ) zijn heel vluchtige vloeistoffen. Ze worden in het laboratorium gebruikt als oplosmiddelen of extractievloeistoffen.
Algemene bereiding
- Dehydratie van een alkanol, verwarmen van een alkanol met geconcentreerd zwavelzuur:
2 C2H5OH → C2H5 - O - C2H5 + H2O
→ alleen symmetrische ethers kun je zo maken! R1 = R2 - Volgens Williamson, een natriumalkanolaat + halogeenalkaan.
C2H5ONa + CH3Cl → C2H5 - O - CH3 + NaCl
→ zo kun je ook asymmetrische ethers maken! R1 ≠ R2
Diëthylether
De belangrijkste bekende ether is diëthylether. Dat is ook de stof die bedoeld wordt als er alleen over 'ether' gesproken wordt. Maar de volledige naam is dus diëthylether of 'ethoxyethaan'. Belangrijke eigenschappen van ether:
- Heel vluchtige vloeistof, kookpunt: 34,6 oC
- Heel brandbaar. Etherdamp is in veel verhoudingen met lucht explosief.
- De damp is zwaarder dan lucht. Het gevaar bestaat dat de damp een explosief mengsel met lucht geeft als een deken op de vloer.
- Ether neemt langzaam zuurstof uit de lucht op om hiermee peroxide te vormen. Hierdoor wordt de ether nog brandgevaarlijker.
- Absolute ether is ether die volkomen vrij van water is. Om absolute ether te maken wordt de ether - na destillatie - bewaard met metallisch natrium (vaak een metaaldraad) die het water bindt.
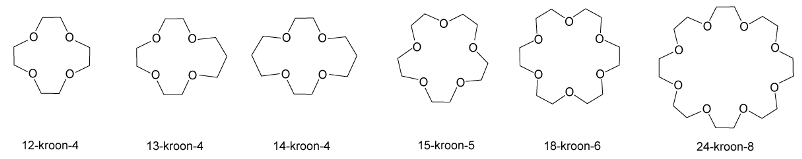
Kroonethers
Een kroonether is een cyclische ether waarmee metaalionen complex gebonden kunnen worden. Zo kan een metaalion ook in een apolaire oplossing aanwezig zijn. De ether zorgt voor deze oplosbaarheid. Voor kleine ionen gebruik je een kleine kroonether, voor grote ionen een grotere. Het type kroonether geven we aan als: 18-kroon-6 (18-crown-6) wat dan wil zeggen: een kroonether van 18 atomen in het molecuul, waarvan 6 zuurstofatomen.
Voorbeelden van kroonethers:
Polyether
Een polyether wordt gemaakt uit een epoxide. Dat kan zijn etheenoxide, propeenoxide, buteenoxide enz. Uit etheenoxide ontstaat PEG. Polyethyleenglycol. De stof kan ook gemaakt worden uit glycol.

Polyethyleenglycol is oplosbaar in water als n niet al te groot is. Toepassingen:
- conserveren van hout
- medisch en cosmetisch (oplosmiddel, emulgator)
- detergent
- bereiding van schuimrubber en schuimplastic
Meer informatie over polyethyleenglycol in wikipedia.