Startpagina mlochemie

Halogeen is een verzamelnaam voor fluor, chloor, broom en jood.
Vaak geven we een halogeen weer met het atoom-symbool X.
Het symbool voor het molecuul is dan: X2
Elk halogeenatoom heeft 7 valentie-elektronen.
Het kleinste halogeen-atoom is dat van fluor. Fluor heeft een extreem hoge EN-waarde. Reacties met fluor zijn vaak onbeheersbaar, zeg maar: explosief. De EN-waarde van het jood-atoom is het laagst. Iets kleiner dan die van koolstof (2,5).
Halogeenalkanen zijn koolwaterstoffen met halogeen in het molecuul. In de natuur komen zulke stoffen nauwelijks voor. Een halogeenalkaan is dan bijna altijd een "chemische stof". Niet zo gek dat het gebruik van deze stoffen door wetgeving is beperkt. Vloeibare en gasvormige halogeenalkanen horen niet thuis in het milieu. Maar komen daar soms wel terecht.
Voorbeelden:
PCB's
Polychloorbifenyl, vloeistof die elektrisch goed isoleert en daarom veel werd gebruikt in transformatoren en condensatoren. Vanaf 1985 verboden wegens giftige eigenschappen. De stof verzamelde zich in het vetweefsel van vissen en vogels en leidde dan tot de dood van zo'n vogel als deze zijn vetreserve ging gebruiken.
PBB's
Polybroombifenyl, wordt gebruikt in kunststofmengsels omdat ze de brandbaarheid verminderen.
CFK's
Chloorfluorkoolwaterstoffen. Verbindingen van methaan waarbij de waterstofatomen vervangen zijn door fluor, chloor of soms broom. Andere namen zijn: halon en freon. Door variatie van de halogenen kun je vloeistoffen maken met verschillende kookpunten. Ideaal voor gebruik in koelkasten en airco's. Ook voor gebruik in kleine brandblussers en als drijfgassen in spuitbussen zijn het mooie stoffen. Maar wel met ernstige nadelen ... CFK's worden sinds 2004 niet meer gebruikt.
Ozongat
De CFK's vormen onder invloed van uv-straling radicalen. Deze radicalen reageren weer met ozon in hogere luchtlagen. De concentratie van ozon wordt daardoor minder en de beschermende werking gaat verloren. Ozon houdt namelijk veel uv-straling tegen die voor het leven op het aardoppervlak schadelijk is. Vooral aan de Zuidpool is de ozonconcentratie laag. Daar zit dus het ozongat.

Overigens is de dunne plek in de ozonlaag niet stabiel, hij varieert door de jaren: KNMI.
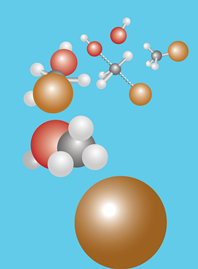 Nucleofiel substitutie
Nucleofiel substitutie
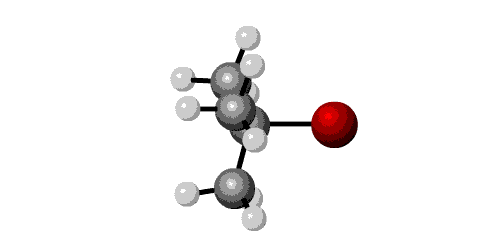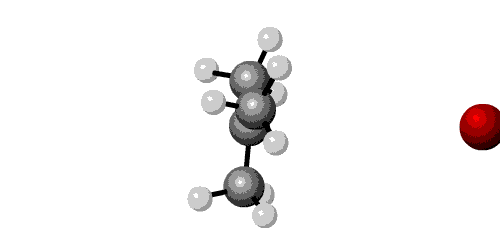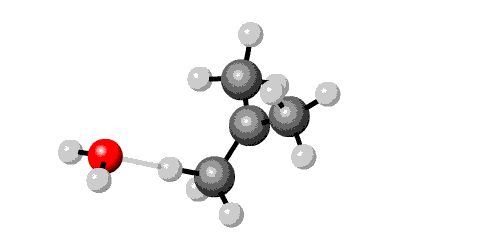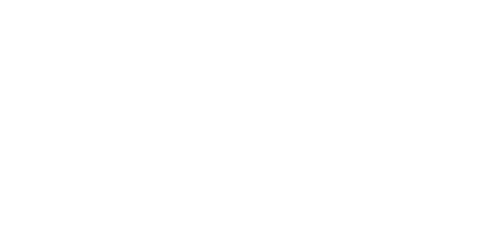
In een laboratorium worden halogeen alkanen veel gebruikt als apolaire oplosmiddelen. Denk aan chloroform. Maar de chemische betekenis is vooral dat zij gemakkelijk reageren in nucleofiele substitiutie reacties. Je kunt er gemakkelijk andere stoffen uit bereiden. En je kunt ook gemakkelijk een halogeenalkaan maken door een andere substituent te vervangen.
Misschien had je al opgemerkt dat een nucleofiele substitutie op de voorkant van je boek staat afgebeeld:
De reactie is: Br- + CH3OH ---> BrCH3 + OH-
De reactie verloopt alleen vlot in zuur milieu. OH- verlaat het molecuul niet gemakkelijk, in zuur milieu ontstaat H2O. Dat is wel een goede 'leaving group'.
Het broomatoom kan weer gemakkelijk vervangen worden door ...
-CN -OH -NH2 -OR
Afhankelijk van reactie-omstandigheden kan hierbij ook eliminatie optreden.
| substitutie | eliminatie | |
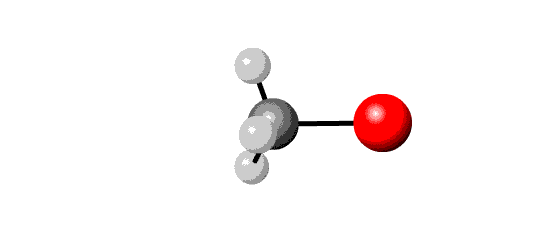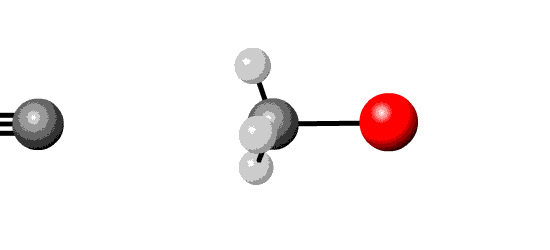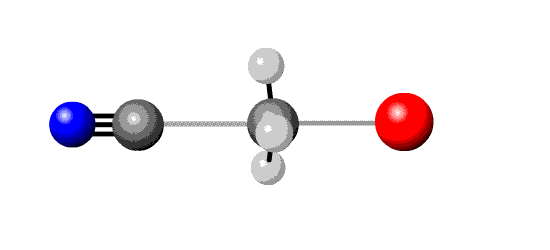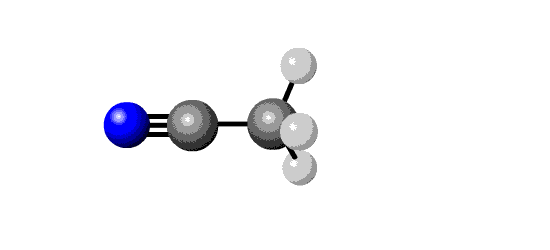 |
 |
Koolwaterstoffen zijn verbindingen van alleen koolstof en waterstof. Daar zijn in hoofdzaak twee typen van: verzadige koolwaterstoffen (alkanen) en onverzadigde koolwaterstoffen. Bij het kraken van aardolie ontstaan veel onverzadigde, vooral veel alkenen en alkynen. De plaats van de dubbele (alkeen) of drievoudige binding (alkyn) wordt aangegeven met een plaatsnummer. Zit in buteen de dubbele binding op het 1e C-atoom, dan is de systematische naam: but-1-een. Voorheen: 1-buteen. Op het 2e C-atoom: but-2-een, voorheen: 2-buteen. De oude naam (plaatsnummer vóór de naam) spreek je gemakkelijker uit en zal nog wel veel gebruikt worden. Maar de IUPAC-voorkeur is dus het plaatsnummer direct voor de uitgang -een of -yn.
De belangrijkste chemische feiten op een rij:
Alkenen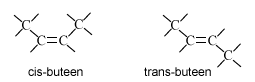
De dubbele binding is niet vrij draaibaar, hierdoor ontstaat cis-trans-isomerie.
Je kunt gemakkelijk een functionele groep in het molecuul aanbrengen door additie van bijvoorbeeld: H2 , H2O , HCl , HBr , Cl2 , Br2 , HCN , H2SO4 enzovoort.
Alkenen kunnen gemakkelijk polymeriseren tot polymeren
Alkynen
De drievoudige binding is weer vrij draaibaar.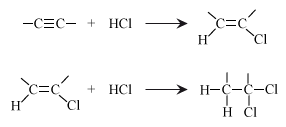
Je kunt weer een functionele groep in het molecuul aanbrengen door additie van bijvoorbeeld: H2 , H2O , HCl , HBr , Cl2 , Br2 , HCN , H2SO4 enzovoort. Je kunt één deeltje adderen maar je kunt ook 2 deeltjes adderen.
Een alkyn met zijn drievoudige binding eindstandig, is heel zwak zuur.
Elektrofiele additie
Elektrofiele additie verloopt in 2 stappen. Een positief deeltje reageert (langzaam) met de π-elektronen. Er ontstaat een carbokation dat snel reageert met een negatief ion:

Mesomerie in het kation
Bij een geconjugeerd dieen gebeurt iets bijzonders. In het carbokation kan de dubbele binding verschuiven in de richting van de positieve C:
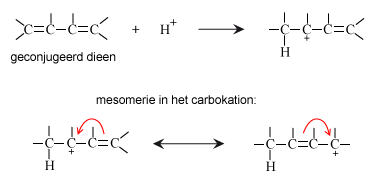
Hierdoor kan het negatieve ion in de tweede stap van de additie op 2 verschillende C-atomen terecht komen.
Uitwerking opgave 26
In hoofdstuk 5 komen enkele opgaven voor die niet specifiek zijn voor de onverzadigde verbindingen. Bijvoorbeeld opgave 25, 26, 27 en eigenlijk ook 29.
Niet zulke gemakkelijke opgaven. Laten we opgave 26 maar eens uitwerken.
We hebben een stofje met M = 296 g/mol.
Je verbrandt 371,4 mg stof.
- dat levert: 993,4 mg CO2 , dat is: 993,4/44 = 22,58 mmol C en: 22,58 x 12 = 270,9 mg C,
- én: 180,6 mg H2O, dat is: 180,6/18 = 10,03 mmol H2O → 20,06 mmol H en: 20,06 mg H,
- de hoeveelheid zuurstof in de 371,4 mg stof is dan: 371,4 - 270,9 - 20,06 = 80,44 mg O, dat is: 80,44/16 = 5,03 mmol O.
De verhouding in mmol en dus ook de verhouding in de brutoformule C : H : O = 22,6 : 20,1 : 5,03
Om naar eenvoudige hele getallen te komen, delen we door het kleinste getal (5,03), dan hebben we: C : H : O = 4,5 : 4 : 1
4,5 atoom is lastig, moet tenminste 9 zijn. De brutoformule zou dan kunnen zijn: C9H8O2
Berekenen we van dit stofje de molaire massa dan vind je: 148 mg/mmol. De werkelijke molaire massa is 296 mg/mmol: 2 maal zo groot.
Dus de formule wordt: C18H16O4
Als je het heel netjes doet zeg je: (9 x 12 + 8 x 1 + 2 x 16) x n = 296. Oplossing: n = 2 en dus formule: C18H16O4
Verzadigde koolwaterstoffen of: alkanen. Algemene formule: CnH2n+2. Maar voor de cyclo-alkanen: CnH2n.
Als je nog moeite hebt met de basisprincipes van de naamgeving van de alkanen ... onze docent (nou ja 'onze'... )legt het graag nog eens uit.
Aardolie
De meeste alkanen komen uit aardolie. Ook komen veel koolwaterstoffen uit steenkool.
Hoeveel aardolie hebben we nog? Het antwoord op deze vraag was 50 jaar geleden: ongeveer 40 jaar. Het antwoord dat we vandaag krijgen is: een jaar of 40 ...
Af en toe worden er nieuwe aardolievelden ontdekt, zodoende. Ook wordt er olie gewonnen die vroeger als erg moeilijk winbaar gezien werd.
Deskundigen verwachten dat in 2020 tot 2030 de productie en het verbuik op een maximum zullen liggen: de Oil Peak. En dat daarna de productie zal dalen, en natuurlijk: de prijs zal stijgen...
Kraken
Bij het kraken van aardolie ontstaan kleinere moleculen. Doordat er bindingen verbroken worden ontstaan er ook onverzadigde verbindingen. Soms is dat een voordeel als je nieuwe functionele groepen wilt aanbrengen. Maar vaak een nadeel als je brandstoffen als benzine wilt bereiden. Het kraakproces wordt daarom op verschillende manieren uitgevoerd:
Stoomkraken
Kraken bij hoge temperatuur (>800 °C) met toevoeging van stoom, geeft veel kleine alkenen. Dus veel stoffen om andere producten mee te maken.
Hydrogenerend kraken
Voegen we waterstof toe aan de olie, dan ontstaan er geen onverzadigde verbindingen.
Katalytisch kraken
Keramische verbindingen van oxiden van Al en Si (zeolieten) werken katalytisch en bevorderen specifieke producten. Wat natuurlijk ideaal is als je veel benzine wilt produceren of juist iets anders.
Als je een olieraffinaderij ziet, lijkt het of er niets gebeurt. Al die buizen en kolommen staan daar maar te staan. Maar, in die kolommen worden dagelijks tonnen aardolie gedestilleerd, gekraakt en opnieuw gedestilleerd.
video met uitleg kraken en destilleren
Vrije draaibaarheid
De sigma-binding tussen de C-atomen in verzadigde koolwaterstoffen staat vrije draaibaarheid van de atomen toe. Van alle mogelijke conformaties is die conformatie het meest stabiel, waarbij de H-atomen zo ver mogelijk bij elkaar vandaan liggen. Dat is te zien in een energiediagram.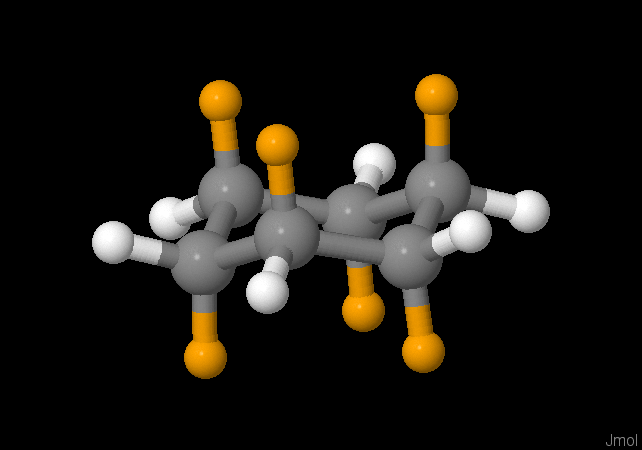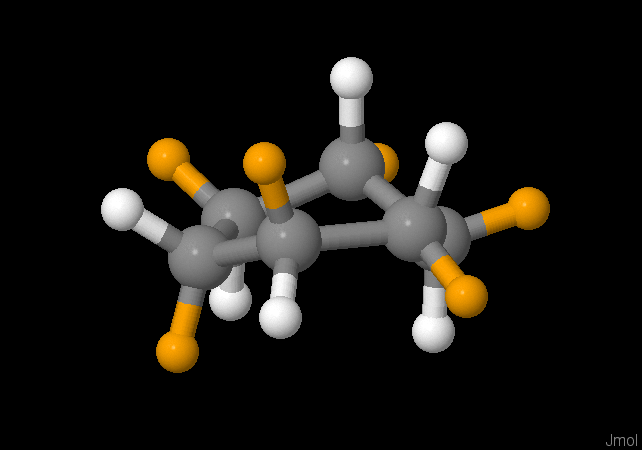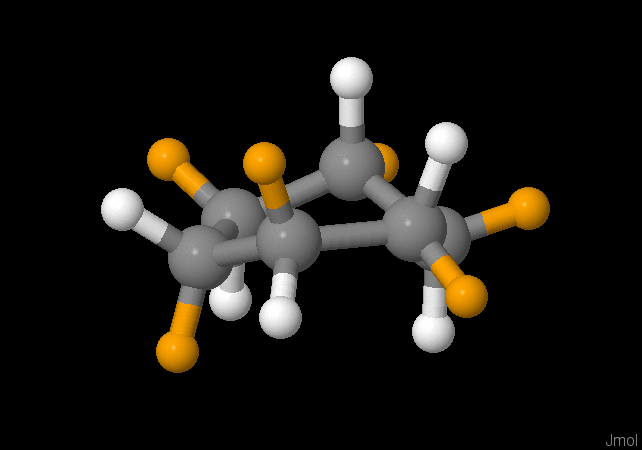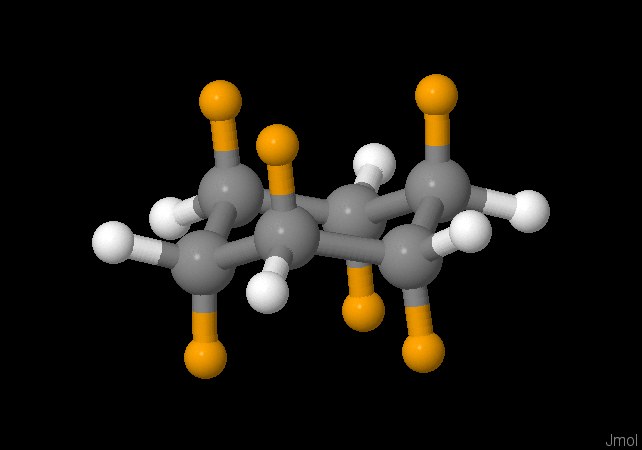
Voor 6-ringen, zoals cyclohexaan, geeft de vrije draaibaarheid aanleiding tot twee stabiele conformaties.
De stoel- en de bootconformatie. In bijgaande animatie zie je hoe de ruimtelijke vorm kan veranderen in een boot of in een stoel. Met een beetje fantasie is dat te zien. De stoel-vorm is het meest stabiel. De atomen zijn dan het verst bij elkaar vandaan.
Heeft het molecuul substituenten (zijgroepen), dan zitten die bij voorkeur zo dat ze in het vlak van het molecuul liggen. We zeggen: equatoriaal.
De ware chemicus is geïnteresseerd in de wijze waarop reacties verlopen. Vooral in de organische chemie is dat zo belangrijk, omdat je op verschillende manieren verschillende producten kunt maken. Zo bestudeert men in de organische chemie vooral die verschillende manieren. Als je een reactie in detail bekijkt, dan kijk je naar het reactiemechanisme. Dat wil zeggen: de stappen waarin de reactie verloopt.
Belangrijke reactietypen zijn:
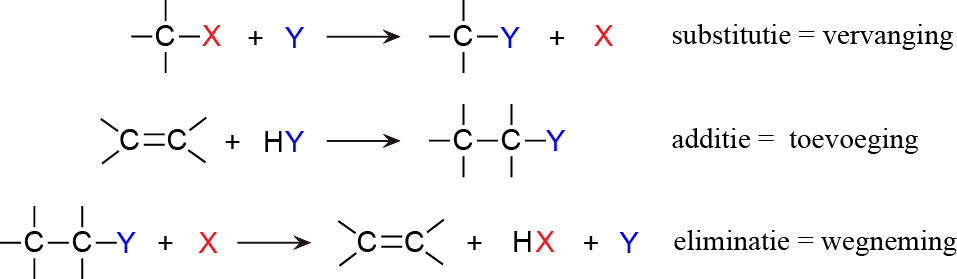
- substitutie
hierbij vervang je een atoom of atoomgroep - additie
hierbij voeg je een molecuul toe - eliminatie
hierbij haal je een deel van een molecuul af
Belangrijke reactieve deeltjes die de reactie kunnen starten zijn:
* Kernminnende = nucleofiele deeltjes. Zij vallen aan op Cδ+, dus op een C-atoom dat een beetje positief is.
Nucleofiele deeltjes zijn bijvoorbeeld: Br-, OH-, RO-, NH3, Cl- en H2O.
Het zijn vaak negatieve ionen, maar in elk geval heeft een nucleofiel deeltje een vrij elektronenpaar.
* Elektronenminnende = elektrofiele deeltjes. Zij reageren op de dubbele bindingen.
Elektrofiele deeltjes zijn bijvoorbeeld: H+, NO2+, BF3 en Cl+.
Het zijn vaak positieve ionen, maar in elk geval komen ze voor achtomhulling elektronen te kort.
Tijdens de reactie kunnen er zeer reactieve deeltjes aanwezig zijn:
+CH3 : een carbokation (in dit voorbeeld de methylgroep, maar dan kan natuurlijk ook een andere alkylgroep zijn).
•CH3 : een radicaal (in dit voorbeeld de methylgroep, maar dan kan natuurlijk ook een andere alkylgroep zijn).
-:CH3 : een carbo-anion (in dit voorbeeld de methylgroep, maar dan kan natuurlijk ook een andere alkylgroep zijn).
Om in een organisch molecuul de functionele groep te veranderen is de substitutie het aangewezen reactietype. Hiervan zijn 2 mechanismen: SN1 en SN2.
SN1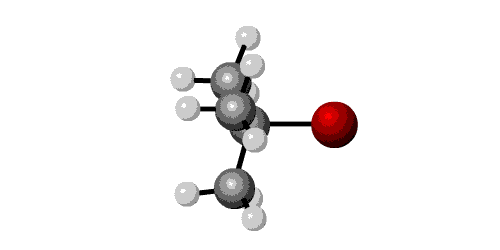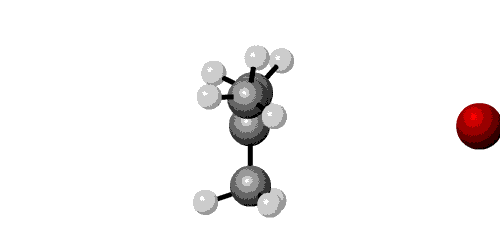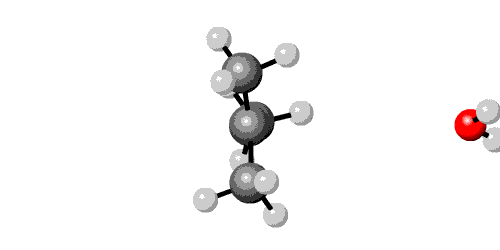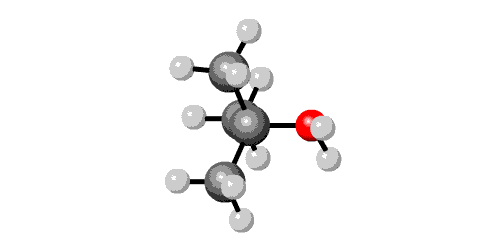
* eerste orde reactie (snelheid hangt af van één concentratie)
* reactie verloopt in 2 stappen
* snelheid: tertiaire C > sec C > prim C
* uittreden groep gemakkelijker: I > Br > Cl > F
* racemisatie: nucleofiel kan aan beide kanten van het carbokation reageren

SN2
* tweede orde reactie (snelheid hangt af van twee concentraties)
* reactie verloopt in 1 stap
* snelheid: primaire C > sec C > tertiaire C
* uittreden groep gemakkelijker: I > Br > Cl > F
* inversie: de bindingen aan de aangevallen C die klappen om
Uitvoerige animatie SN1 met het energieprofiel.
Uitvoerige animatie SN2 met het energieprofiel.
Eliminatie
In plaats van een substitutie kan ook eliminatie plaatsvinden. Hierbij wordt een substituent verwijderd, terwijl ook een proton aan het deeltje wordt onttrokken. Er ontstaat een alkeen. De meest vertakte alkeen heeft de voorkeur.
Voor eliminatie zijn nodig:
* sterke base, bijv. OH- of RO-
* polair oplosmiddel, bijv. een alkanol
* vertakte C