Startpagina mlochemie
NMR is een heel specialistische vorm van spectrometrie. Samen met massa-spectrometrie en infrarood-spectrometrie wordt NMR gebruikt om van organische stoffen de structuur te bepalen. Een analist die met NMR werkt is dan ook een specialist. Hoofdstuk 14 uit het boek is dan ook alleen bedoeld om je een idee te geven van NMR. Waar gaat het over?
Wel....een NMR spectrum laat het volgende zien:
1 de grootte van de piek of het piekoppervlak geeft het aantal H-atomen (protonen),
2 de plaats op de X-as (chemical shift) geeft het type H-atoom, dat wil zeggen: waar in het molecuul dit H-atoom zit,
3 de splitsing van de piek in kleine piekjes laat zien hoeveel naburige H-atomen er zijn.
Als voorbeeld C3H6Cl2:
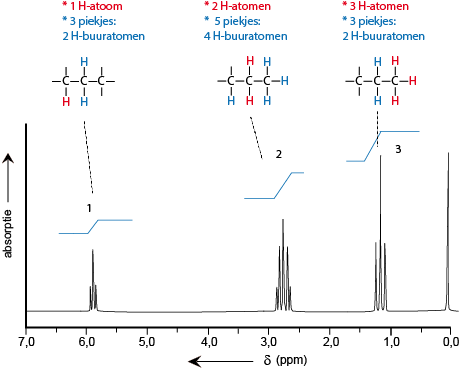
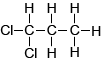 |
De structuur van 1,1-dichloorpropaan klopt met het gemeten spectrum. Zie hier boven. |
 |
De structuur van 2,2-dichloorpropaan klopt niet. In 2,2-dichloorpropaan zijn alle H-atomen gelijk geplaatst. Dus in het NMR-spectrum zou je slechts 1 piek moeten zien.... |
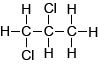 |
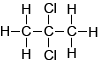
1,2-dichloorpopaan klopt ook niet. Zo zou de CH3-groep 2 piekjes moeten geven. Evenals de H-atomen van de CH2-groep. 1,2-dichloorpropaan kan het dus niet zijn. |
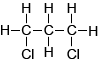 |
1,3-dichloorpropaan zou 2 pieken moeten geven: 4 gelijkgeplaatste H's en de CH2-groep. Opsplitsing in 3 en in in 5 piekjes... Ook dat is niet het geval. |
Het is niet eenvoudig om duidelijk te maken hoe het NMR-spectrum ontstaat.
In elk geval geldt dat protonen kunnen resoneren (trillen) in een magneetveld. Door absorptie van straling nemen zij energie op. Bij terugvallen naar een lagere energie-toestand, zenden ze weer straling uit. Dit is de resonantie-frequentie. Dit gebeurt bij de juiste combinatie van:
- ingestraald vermogen,
- ingestraalde frequentie,
- veldsterkte van de magneet.
Extra uitleg van de interpretatie van nmr-spectra....
Kun je krijgen in deze pdf. Met dank aan Hans J. Reich van de Universiteit van Wisconsin. Ook heel geschikt om samen, of in klassenverband te bespreken. In deze uitleg:
- blauwe pieken zijn ingezoomd,
- omcirkeld: aantal H's van de piek,
- onderstreept: nabuur H's die opsplitsing veroorzaken.
Specialisme
Voor alle zekerheid nogmaals: NMR is een specialisme. De absorpties die gegeven worden in de tabellen voor H-atomen zijn bijvoorbeeld nog afhankelijk van de meetomstandigheden. Vooral voor H-atomen in bijvoorbeeld een OH-groep of NH2-groep. Door waterstofbruggen verschuift de absorptiepiek.
En verder....
Is hier weer een kleine test.
En ook een kort kruiswoord om de nieuwe begrippen te leren. En te leren spellen!
Uitdagingen
Tja. De uitdagingen gaan misschien wel weer boven de MLO-leerstof en leerdoelen uit maar ja.... wij leren niet voor de school maar wij leren voor het beroepsleven niet waar?
Een mooie oefen-site ...
- kies voor 1H-NMR en dan voor een spectrum met twee sterren (**),
- kies voor "continue" voor de stapsgewijze oplossing,
- klik (indien mogelijk) op "hint" om de absorptietabel te zien.
Massaspectrometrie is een apart vak. Voor de laboratoriumroutine is het belangrijk als detectie na ICP, GC of HPLC. De deeltjes (atomen, moleculen) die de massaspectrometer binnenkomen worden omgezet tot positieve ionen. Daarna worden deze ionen gescheiden op massa/lading en gedetecteerd.
Het liefst hebben we ionen met als ladingsgetal (z): 1+. Verder is het mooi als de moleculen niet al te veel uit elkaar vallen. Als een molecuul nog heel is maar wel een ladingsgetal van 1+ heeft, dan kun je de molecuulmassa meteen uit het spectrum aflezen! De piek die hier bij hoort noemt men de "parent peak". Vlak naast de parent peak vind je vaak een veel kleiner piekje dat een 1 u grotere massa heeft. Dit is ook een molecuulpiek maar dan met één C-13 isotoop in het molecuul. Dit is dan een extra aanwijzing voor de molecuulmassa! Zie hieronder ethanol:

Er is over dit onderwerp best veel te vinden op het web. Hieronder een selectie die qua niveau aansluit bij het hoofdstuk:
Eenvoudige uitleg in het Nederlands op de "Al je vragen" site.
Uitstekend filmpje, maar wel Engelstalig, gewoon een paar keer op je in laten werken.... youtube.
Werking van een Quadrupool.
Een mooi filmpje over de reis van moleculen in een massaspectrometer.
En verder.....
Trillende atomen in een molecuul absorberen infrarode straling als de trillende atomen een dipool hebben. De frequentie van de straling is gelijk aan de frequentie van de trillende atomen. Een IR-absorptiespectrum van een stof heeft daardoor karakteristieke absorpties. Je kunt zien welke atomen of atoomgroepen aanwezig zijn. Je kunt dus conclusies trekken over de structuur van de moleculen.
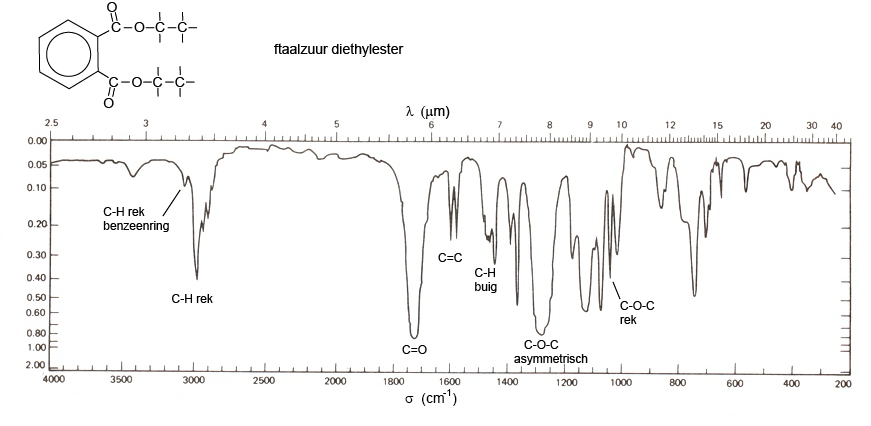
Hieronder staat het absorptiespectrum van de diethylester van o-ftaalzuur. In het spectrum is te zien dat de moleculen.....
-een benzeenring hebben (niet zo gemakkelijk te zien),
-alkylgroepen hebben,
-een C=O groep heeft (het zijn er twee maar dat kun je in het spectrum niet goed zien),
-een C-O-C groep heeft.
Er is nog meer te zien maar het is evengoed niet eenvoudig om conclusies te trekken. Computerprogramma's met bibliotheken met spectra van bekende stoffen helpen hierbij. Het blijft werk voor specialisten.
Metingen doe je met een dubbelstraals dispersie instrument of met FTIR. Een dipersie-insrtument meet op de klassieke manier: een monster wordt gescand, golflengte voor golflengte meet je de transmissie (of extinctie). Zo ontstaat in enkele minuten een absorptiespectrum. De FTIR meet alle golflengten tegelijk. Er ontstaat een interferogram, dat met "Fourier-analyse" wordt omgezet tot een absortiespectrum. Zie boek voor een uitgebreidere beschrijving.
In elk geval is het nodig watervrij te werken. Water absorbeert namelijk ook IR-straling en lost de cuvetten op. De cuvetten zijn gemaakt van zouten als KBr, NaCl, CsCl2. Dit is nodig omdat glas, kwarts en kunststof ook teveel IR absorberen en de meting dus storen.
Eenvoudige uitleg en wel in het Nederlands. Weliswaar gaat deze uitleg over dubbelstraals dispersiemeting en niet over FTIR:IR.
Een heel goed Engelstalig filmpje (FTIR) dat een en ander nog eens laat zien.... zie je hier.
En verder......
 Sommige moleculen kunnen licht geven. We noemen dit chemisch licht luminescentie. Je kent vast de "light stick" wel. Een kunstof buisje waar chemicaliën in zitten die als ze met elkaar reageren licht geven. Chemoluminescentie zeggen we dan. Een nog mooier voorbeeld is het vuurvliegje of glimwormpje. Een glimworm laat in het uiteinde van zijn lichaam een biochemische reactie verlopen waardoor hij licht geeft. Een manier - voor de mannetjes - om een vrouwtje te vinden en andersom. Ook, zeggen biologen, om vogels af te schrikken: "wij zijn niet eetbaar...."
Sommige moleculen kunnen licht geven. We noemen dit chemisch licht luminescentie. Je kent vast de "light stick" wel. Een kunstof buisje waar chemicaliën in zitten die als ze met elkaar reageren licht geven. Chemoluminescentie zeggen we dan. Een nog mooier voorbeeld is het vuurvliegje of glimwormpje. Een glimworm laat in het uiteinde van zijn lichaam een biochemische reactie verlopen waardoor hij licht geeft. Een manier - voor de mannetjes - om een vrouwtje te vinden en andersom. Ook, zeggen biologen, om vogels af te schrikken: "wij zijn niet eetbaar...."
Fluorescentie
Voor de laboratoriumpraktijk is een speciaal geval van luminescentie van belang: fluorescentie. Bij fluorescentie meten we de intensiteit van het uitgezonden licht. Bij lage concentraties is de emissie evenredig met de concentratie. Dat komt goed uit: in het analytisch lab meten we graag lage concentraties! Jammer genoeg kunnen niet zoveel stoffen fluoresceren. Maar als ze het doen dan kun je de concentratie meten.Fluorescentie verloopt als volgt: {module animfluorescentie} - Een molecuul absorbeert elektromagnetische straling van korte golflengte, meestal: uv-licht. Het molecuul komt in "aangeslagen toestand". We zeggen: geëxciteerd". Het ingestraalde licht noemen we: de excitatiegolflengte.
-Het molecuul verliest energie door botsingen met andere moleculen, we noemen dit: relaxatie.
-Het molecuul verliest de rest-energie weer door emissie van straling. Wel van langere golflengte dan die werd geabsorbeerd.
De geëmitteerde straling gaat alle richtingen uit.
Verloopt dit proces snel dan is het fluorescentie. Verloopt het proces langzaam dan is het fosforescentie. Fosforescentie is "nalichten" terwijl fluorescentie meteen gebeurt. Fluorescentie wordt gebruikt om concentraties te meten. Het zijn vooral starre moleculen met dubbele bindingen die fluoresceren.
De hoofdzaken bij fluorescentiemetingen:
-Er is een monochromator voor de excitatie-golflengte. Deze moet je dan ook instellen op de juiste golflengte.
-Er is een monochromator voor de emissie-golf. Ook deze golflengte moet je instellen.
-De emissie wordt gemeten haaks op de excitatie-golf. De fluorescentie is in alle richtingen.
En verder....