Startpagina mlochemie
Chromatografie gaat over scheidingstechnieken. Door de scheidingsvariabelen nauwkeurig te meten kun je stoffen identificeren en kwantificeren. Bekend is natuurlijk papierchromatografie en dunne-laagchromatografie. Meestal afgekort tot TLC van: 'Thin Layer Chromatography' of HPTLC van 'High Performance Thin Layer Chromatography'.
Bij TLC meten we de loopafstand van de component en de loopafstand van de mobiele fase (eluens). Je berekent de Rf-waarde. Dat wil zeggen: loopafstand component gedeeld door loopafstand eluens.
Andere vormen van chromatografie zijn gaschromatografie en hoge druk vloeistofchromatografie. Dit zijn instrumentele technieken. Zo belangrijk dat daar aparte hoofdstukken aan gewijd zijn. Bij deze instrumentele technieken meten we niet de afstand maar de tijd.
In de animatie gaan we uit van een gaschromatograaf.
Het monster wordt geïnjecteerd en door de kolom gevoerd. In de kolom worden de componenten van elkaar gescheiden. Een detector "ziet" de verschillende componenten langskomen en geeft een signaal.
Je meet: 
- brutoretentietijd component
tR de tijd die de elutie duurt - tijd onvertraagde component (oplosmiddel)
tM de tijd die de mobiele fase nodig heeft
Je berekent:
- nettoretentietijd
t'R dat is de tijd die de component in of op de stationaire fase doorbrengt. - relatieve retentie
r dat is de verhouding tussen twee nettoretentietijden, bijvoorbeel van een component en een interne standaard.
En verder kunnen we een hele reeks aan variabelen afleiden die de kwaliteit van de scheiding of van het instrument beschrijven.
Schotelgetal (N)
Het schotelgetal is een dergelijke variabele. Hoe goed een scheidingskolom stoffen van elkaar kan scheiden hangt af van de kolomlengte en de snelheid van het eluens. Hoe vaker tijdens de reis door de kolom evenwicht is tussen de concentratie in de stationaire fase en mobiele fase, des te beter de scheiding. Dit aantal evenwichten wordt uitgedrukt in het schotelgetal. Dit is voor een chromatografiekolom een theoretische waarde. Je berekent N met de formule hieronder.

Het begrip schotelgetal komt uit de destillatietechniek. Bij aardoliedestillatie zijn er echte schotels in een destillatiekolom. Op elke schotel is er evenwicht tussen vloeistof en damp.
Bij potentiometrie meet je een elektrodepotentiaal. Dat is de elektrische spanning tussen het elektrode-materiaal en de oplossing. Deze potentiaal is afhankelijk van één van de reagerende deeltjes in de oplossing. De opstelling bestaat altijd uit twee elektroden:
- meetelektrode
- referentie elektrode
Ook al is de sensor die in de oplossing steekt vaak maar één staafje..... Er zitten dan toch twee elektroden in. Een dergelijke sensor met daarin twee elektronen wordt ook weer "elektrode" genoemd. Voor veel verschillende toepassingen zijn er ook veel verschillende elektroden. Hier een setje elektroden van de firma Mettler:

pH
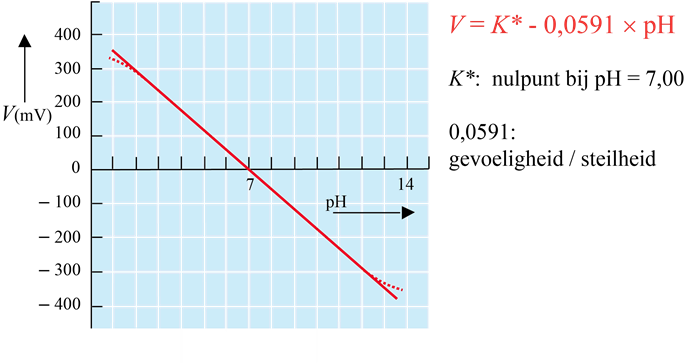
De meest bekende potentiometrische meting is de pH-meting. Zoals bij iedere sensor zijn er in het meetcircuit verschillende spanningen. Maar er is één spanningsprong die afhangt van de pH. Alle overige zijn constant. Zo ontstaat de van de wet van Nernst afgeleide formule:
V = V* - 0,0591 x pH
Zuurfout
Bij heel lage pH raakt het glasmembraan volledig bezet met H3O+. Hierdoor is het pH-verloop bij nog lagere pH niet meer lineair. De pH die je afleest is dan iets hoger dan in werkelijkheid. Dit heet de "zuurfout".
Alkalifout
Bij heel hoge pH stoort het natrium-ion. Nu is de pH die je afleest iets lager dan in werkelijkheid.

Titreren
Potentiometrie is vooral: eindpuntbepaling bij titraties. Ook het volgen van de titratie. We zetten de gemeten elektrodepotentiaal ten opzichte van een referentie op de Y-as en het volume getitreerd op de X-as. Bij de potentiaalsprong vind je het titratie-eindpunt.
De elektrodepotentiaal volgt de wet van Nernst. Titreren wij bijvoorbeeld ijzer(II)-ionen tot ijzer(III)-ionen, dan wordt het ijzer geoxideerd. In de formule van Nerst staan - in de breuk na het log-teken - de concentraties van de "oxidatorkant" boven de streep. 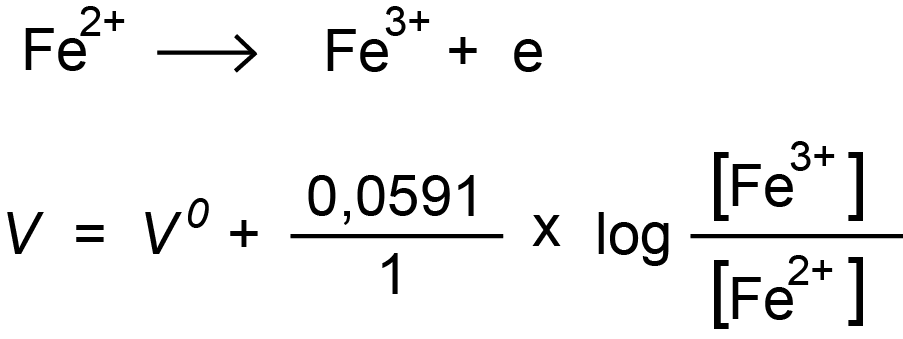 Deze titratie voer je uit met een oxidator. Tijdens de titratie neemt [Fe2+] af. Terwijl [Fe3+] groter wordt. De breuk als geheel wordt dus groter: de spanning V stijgt. De titratiecurve is stijgend. Dit is algemeen zo:
Deze titratie voer je uit met een oxidator. Tijdens de titratie neemt [Fe2+] af. Terwijl [Fe3+] groter wordt. De breuk als geheel wordt dus groter: de spanning V stijgt. De titratiecurve is stijgend. Dit is algemeen zo:
- titreer je met een oxidator, dan stijgt de curve,
- titreer je met een reductor, dan daalt de curve.
Theorie & praktijk
De elektrodepotentiaal is in principe te berekenen met de wet van Nernst. Hierbij gebruik je de redoxpotentialen uit tabel II in het boek. Of uit een andere bron zoals BINAS. Of Wikipedia. Je zal merken dat er soms kleine verschillen zijn tussen de waarden voor dezelfde reactie, maar uit verschillende tabellen.
Ook als je zelf metingen doet en deze vergelijkt met berekende waarden, dan zie je verschillen.
Het is goed te bedenken dat de formule van Nernst een model is. In de echte praktijk kunnen er allerlei oorzaken zijn voor afwijkingen van dit model:
- ionen kunnen compexen vormen waardoor de vrije ionconcentratie niet is wat je verwacht,
- er kunnen verontreinigingen zijn aan de elektroden
- de instelling van het chemisch evenwicht kan langer duren dan je denkt
- andere aanwezige ionen kunnen storen
De kleine verschillen in tabelwaarden kunnen veroorzaakt worden doordat de tabelwaarden niet gemeten zijn maar berekend uit thermodynamische waarden. In deze waarden kunnen ook weer kleine verschillen voorkomen.
Een heel uitgebreide tabel met redoxpotentialen vind je in Wikipedia
Elke analysetechniek is een specialisme. Zo ook de technieken van de elektrochemie. In hoofdstuk 16 vind je alleen een algemeen overzicht en geen diepgaande theorie. De meest voorkomende elektrochemische analyse is de potentiometrie. Op bijna elk laboratorium een gebruikte analyse. Daarom een apart hoofdstuk over dit onderwerp: Hoofdstuk 17. De overige elektrochemische technieken worden hier globaal genoemd. Een beknopt overzicht:
Coulometrie
- In principe is coulometrie hetzelfde als titreren.
- Je titreert met een titrant die aan de elektrode wordt gegenereerd.
- Je hoeft geen titrant in voorraad te houden.
- Je hoeft de sterkte (titer) niet te bepalen.
- Je meet (het apparaat doet dit voor je) de stoomsterkte (I) en de tijd (t).
Voorbeelden:
Ag --> Ag+ + e het Ag+ reageert nu met Cl-, zo wordt het chloride gemeten.
2 I- --> I2 + 2 e het I2 reageert nu met bijvoorbeeld SO2 en H2O, zo wordt het watergehalte gemeten.
Belangrijke formules: q = I x t en: n = q / F
Conductometrie
- Je meet het omgekeerde van de weerstand: de geleidbaarheid in Siemens.
- Hoe meer ionen in de oplossing des te hoger de geleidbaarheid.
- Kan gebruikt worden voor het bepalen van een titratie-eindpunt.
- Wordt veel gebruikt voor bepaling van het zoutgehalte (hoeveelheid ionen) in drink-, afval, oppervlakte- en zeewater.
Voorbeeld:
Bij een zuur- basetitratie is er voor het eindpunt veel zuur (of base) en na het eindpunt veel base (of zuur). De geleidbaarheid is minimaal in het equivalentiepunt. Door voortdurend de geleidbaarheid te meten kun je grafisch dit minimum vinden. Kost veel tijd en wordt daarom niet algemeen toegepast maar in bijzondere gevallen kan het.
Belangrijke formules: G = 1 / R G = γ x A / l
Bi-amèrometrie
- Bi-ampèrometrie is een eindpuntbepaling.
- Je meet de sterkte van een heel geringe stroom tussen twee Pt-elektrodes.
- Vaak in combinatie met coulometrische titratie.
Polarografie
- Je meet een grensstroom bij een voor het deeltje typerende spanning, met een kalibratiecurve wordt hiermee de concentratie bepaald.
De algemene toepassing gebruikt een kwik-elektrode die langzaam druppelt. Het elektrode-oppervlak is daardoor steeds schoon.
Bij chemische analyse met instrumenten (apparatuur) is altijd elektrische stroom nodig. Natuurlijk omdat de apparatuur alleen werkt als er een stroombron is. En elektriciteit speelt ook een rol in het meetsignaal. Maar er zijn ook metingen waarbij elektriciteit deel uitmaakt van de meting zelf. Daar gaan de hoofdstukken 15, 16 en 17 over. Elektrochemie.
Elektrische stroom bestaat uit bewegende lading: de elektronen in een draad en de ionen in een oplossing. De overgang tussen de draad en de oplossing gaat via een elektrode. Aan de elektrode is er elektronenoverdracht: een oxidatie- of reductie-reactie. Voor de namen van de elektroden is er de volgende afspraak:
Anode:
- hier worden deeltjes geoxideerd
- hier staan deeltjes elektronen af aan de elektrode
- de elektronen bewegen van de anode door de draad naar de kathode
Kathode:
- hier worden deeltjes gereduceerd
- de elektrode staat elektronen af aan de deeltjes in de oplossing
Welke elektrode is de plus en welke de min......? Tja, dat kun je zo niet zeggen. Dat hangt er van af: levert de cel stroom (galvanische cel) of is er een uitwendige spanningsbron (elektrolyse cel)? Bekijk hiervoor de afbeeldingen.
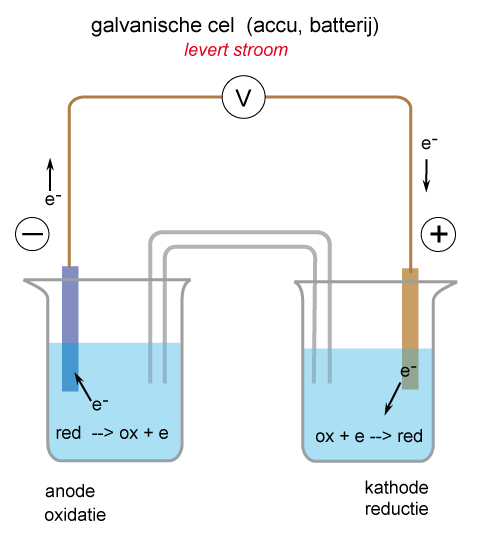
De galvanische cel levert stroom. De anode, waar de oxidatie plaatsvindt, is negatief door de elektronen die uit het elektrolyt komen. De kathode is positief doordat de elektronen worden opgenomen door het elektrolyt.
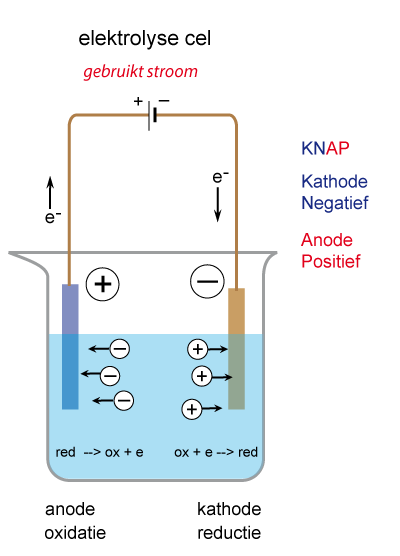
De elektrolyse cel werkt met een uitwendige spanningsbron. Er staat spanning op de elektroden van buitenaf. De anode (weer de elektrode waar de oxidatie plaatsvindt) is nu positief. De negatieve ionen van het elektrolyt gaan naar de anode en worden hier ontladen (geoxideerd!).De kathode is negatief. De positieve ionen van het elektrolyt bewegen naar de kathode en krijgen hier elektronen (reductie!).