Startpagina mlochemie
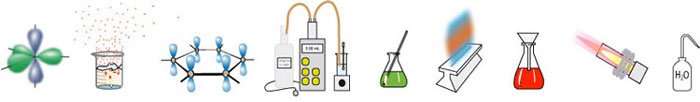
 Een complex is een verbinding waarbij een metaalion wordt omringd door liganden. Een ligand is een molecuul of ion met één of meer vrije elektronenparen. Het ligand geeft als het ware zijn elektronenpaar aan het centraalatoom. Te leen. Want de elektronen gaan niet helemaal naar het centraal atoom. Je kan ook zeggen: "niet voortdurend".
Een complex is een verbinding waarbij een metaalion wordt omringd door liganden. Een ligand is een molecuul of ion met één of meer vrije elektronenparen. Het ligand geeft als het ware zijn elektronenpaar aan het centraalatoom. Te leen. Want de elektronen gaan niet helemaal naar het centraal atoom. Je kan ook zeggen: "niet voortdurend".
Als het complex uit elkaar valt gaan de elektronen gewoon weer mee met het ligand.
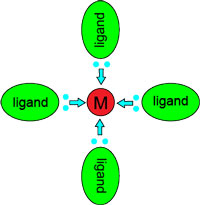
Water is zo'n ligand. De negatieve kant van het watermolecuul hecht zich aan een positief ion.
Een gehydrateerd metaalion is dus een complex.
EDTA
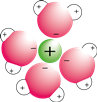
Een bijzonder ligand is edta (ethyleendiaminetetraazijnzuur). Het EDTA-molecuul heeft 6 elektronegatieve groepen met daarin vrije elektronenparen:
* 4 carboxylgroepen (rood) * 2 aminogroepen (blauw)
Onder: in de zwarte cirkels zie je de 6 elektronegatieve groepen. Het molecuul vouwt zich rond een metaalion: rechts in het plaatje.
 EDTA is daardoor een 6-tandig ligand. Een metaalion wordt door het molecuul "gevangen in een kooi" als het ware.
EDTA is daardoor een 6-tandig ligand. Een metaalion wordt door het molecuul "gevangen in een kooi" als het ware.
Met EDTA kun je heel goed metaalionen titreren. Dit noemen we complexometrie.
Eigenschappen complexometrie:
* EDTA in de buret
* pH in het titratievat hangt af van het te "vangen" ion, in de regel: licht basisch of neutraal.
* de indicator geeft zelf een gekleurd complex met het metaalion, om alle ionen met EDTA te vangen moet je dus door titreren tot de kleuromslag volledig is.
Terminologie
Vooral in het Engels kom je verschillende benamingen tegen voor complexen:
| complex | complex |
| coördination compound | complex |
| chelate (spreekuit: kieleete) | complexvormer, dus eigenlijk meer het ligand |
| masking agent | maskeer-middel, complexvormer, dus eigenlijk het ligand |
Hard water
Hard water bevat veel calcium en mogelijk magnesium-ionen. Maar het gaat vooral om Ca2+. De belangrijkste nadelen van hard water:
* Ca2+ reageert met anionogene zeepmoleculen, dus zeep dat een negatief ion is. Er is dan meer zeep nodig voor het wasproces.
Het calcium-zeep neerslag draagt bij aan de "grauwsluier". Bij het handenwassen met hard water merk je het ook.
* Ca2+ reageert met carbonaat dat uit HCO3- ontstaat bij verwarmen: 2 HCO3- ---> H2O + CO32- Ca2+ + CO32- ---> CaCO3↓
Dit calciumcarbonaat is het bekende "ketelsteen". De afzetting op verwarmingselementen in de wasmachine of in het koffiezetapparaat.
Hardheid is belangrijk in het dagelijks leven maar ook in fabrieken waar water gebruikt wordt. Daarom wordt de hardheid veel gemeten. De hardheid verschilt in Nederland per regio:
verder....
"Argentometrie" wil zeggen: titreren met zilverionen. Zilverionen reageren met chloride-ionen:
Ag+ + Cl- → AgCl↓
Met chloride-ionen. Maar let op: ook met bromide, jodide, carbonaat en fosfaat-ionen. Deze ionen kunnen dus storen. Het hangt dus van de monstersamenstelling af. Titreer je in zuur milieu (Volhard) dan heb je geen last van carbonaat en fosfaat-ionen. Deze reageren dan met het zuur.
Er zijn twee uitvoeringen: Mohr en Volhard.
Titratie volgens Mohr
* we titreren met een AgNO3-oplossing
* in neutraal milieu
* indicator: K2CrO4
Titratie-reactie: Ag+ + Cl- → AgCl↓ Indicatorreactie: 2 Ag+ + CrO42- → Ag2CrO4↓ (rood)
Titratie vogens Volhard
* terugtitratie van een overmaat AgNO3
* we titreren met een KCNS-oplossing in zuur milieu
Oxidimetrie gaat over titreren met redoxreacties. Je zou kunnen zeggen: "titreren met elektronen". Vergelijk dit met het titreren met protonen bij zuur/base-titraties. Er zijn dan twee mogelijkheden:
Oxidator in de buret, bijvoorbeeld: kaliumpermanganaat (KMnO4), de toepassing noemen we "permanganometrie", of: cerium(IV)sulfaat (Ce(SO4)2). In principe zijn verschillende andere oxidatoren die we in een buret kunnen doen. Maar, kaliumpermanganaat en cerium(IV)sulfaat worden wel het meest toegepast.
Bij permanganometrie is de halfreactie van de oxidator altijd: MnO4- + 8 H3O+ + 5 e → Mn2+ + 12 H2O
Reductor in de buret, bijvoorbeeld: natriumthiosulfaat (Na2S2O3), de toepassing noemen we: "jodometrie", of: ijzer(II)sulfaat in zuur milieu. Deze twee zijn de meest toegepaste.
Bij jodometrie zijn er altijd de volgende reacties:
oxidator + 2 I- → I2 + reductor
Daarna reageert natriumthiosulfaat (titratiereactie):
I2 + 2 S2O32- → 2 I- + S4O62-
Het titratie-eindpunt kan potentiometrisch worden bepaald. De meetelektrode is platina. We kunnen ook een indicator gebruiken. Redox-indicatoren hebben in geoxideerde vorm een andere kleur dan in gereduceerde vorm. Het bekendste voorbeeld is feroïne. Geoxideerd is feroïne licht blauw en gereduceerd rood.
Berekeningen
Chemische berekeningen zijn in de oxidimetrie lastig omdat de reactieverhoudingen vaak niet zo simpel zijn. Misschien leuk (nou ja: nuttig) om een rekenvoorbeeld te geven? We kijken dan naar opgave 10 in hoofdstuk 4. Deze zelfde opgave maar met andere getallen:
Chloorbleekloog (bleekwater) bevat chloor opgelost met NaOH:
Cl2 + 2 OH- → ClO- + H2O + Cl-
Bij toevoeging van zuur komt het chloor weer vrij:
ClO- + Cl- + 2 H3O+ → Cl2 + 3 H2O
Het chloor dat gebonden is en op bovenstaande wijze kan worden vrijgemaakt noemt men: "werkzaam" of "actief" chloor.
Een analist weegt 1252 mg chloorbleekloog af en voegt na verdunnen toe: 2 g KI en 10 mL zoutzuur (c(HCl) = 4 mol/L). Hij titreert het vrijgekomen jood met 12,32 mL natriumthiosulfaatoplossing met c(Na2S2O3) = 0,1052 mol/L.
Bereken het gehalte aan actief chloor in g Cl2 per 100 g oplossing.
> Reacties:
Cl2 + 2 I- → I2 + 2 Cl-
I2 + 2 S2O32- → 2 I- + S4O62-
Hieruit volgt dat 1 mmol chloor (Cl2) reageert met 2 mmol thiosulfaat (S2O32- )
> Gehaltebepaling, dus start de berekening met de titratie-uitkomst: verbruik: 12,32 mL x 0,1052 mmol/mL = 1,296 mmol S2O32-
> Dit heeft gereageerd met 0,5 x 1,296 = 0,6480 mmol Cl2 Dit is: 0,6480 mmol x 70,91 mg/mmol = 45,95 mg chloor.
> Massa (gram) chloor per 100 g chloorbleekloog:
0,04595 g / 1,252 g = 0,0367 g chloor per 1 g bleekwater ---> x 100 = 3,67 g chloor/100g bleekwater
Opgave 10 uit het boek moet nu ook te doen zijn....
Het onderwerp "Oxidimetrie" komt ook voor in Basischemie voor MLO, hoofdstuk 18. Kun je ook nog eens een kijkje nemen en de test maken.
en verder....
Acidimetrie is de volumetrische analysetechniek waarbij er sterk zuur (meestal zoutzuur) in de buret zit of sterke base (meestal natronloog). De buret is het toestel waarmee je nauwkeurig de titrant kan doseren. Het kan met een glazen buis met een maatverdeling, maar een professioneel laboratorium zal voor motorzuigerburetten kiezen. Als de analyse vaak gedaan wordt: half of heel automatisch. Voor enkele voorbeelden:
 |
 |
 |
Tijdens een "acidimetrische" titratie verandert de pH. Het theoretisch titratie-eindpunt is in de pH-sprong. Daar waar de pH het sterkst verandert. Om het volume te vinden waarbij dat het geval is, gebruiken we een indicator of pH-meter.
|
A Titratie van een sterk zuur: Natronloog in de buret, sterk zuur in de titratiekolf. De pH stijgt sterk rond pH = 7. |
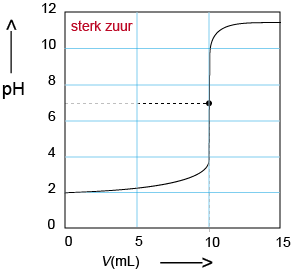 |
|
B Titratie van een zwak zuur: Natronloog in de buret, zwak zuur in de titratiekolf. Het eindpunt ligt iets boven pH = 7. Er is in het eindpunt een zwakke base in de oplossing. |
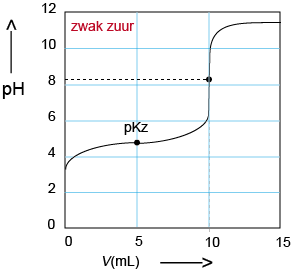 |
|
C Titratie van een tweewaardig zwak zuur: Natronloog in de buret, zuur in de titratiekolf. Het eindpunt ligt boven pH = 7 want er is weer een zwakke base in de oplossing. Er zijn nu twee pH-sprongen, voor elke H+ van het zuur is er een sprong. |
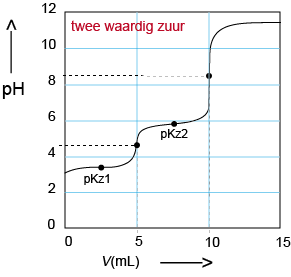 |
|
D Titratie van een sterke base: Zoutzuur in de buret, sterke base in de titratiekolf. De pH daalt sterk rond pH = 7. |
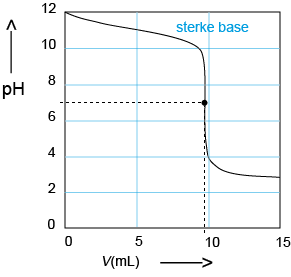 |
|
E Titratie van een zwakke base: Zoutzuur in de buret, zwakke base in de titratiekolf. De pH daalt sterk rond pH = 7. Halverwege is er weer een situatie waarbij er evenveel zwakke base als zwak zuur aanwezig is. De pH is dan gelijk aan de pKz van het zwakke zuur. |
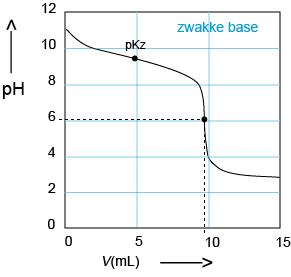 |
|
F Titratie van een tweewaardige zwakke base: Zoutzuur in de buret, base in de titratiekolf. Er zij twee pH-sprongen. Voor elke reactiestap één. Tweemaal is er nu een situatie met evenveel zwakke base als zwak zuur. De pH is dan steeds weer gelijk aan de pKz van het zwakke zuur. |
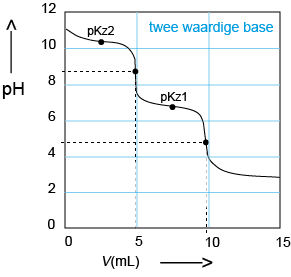 |
|
|
Hiernaast staan nog eens enkele veel gebruikte indicatoren met hun kleuromslag. Vraag: Welke indicator kun je gebruiken voor elk van de bovenstaande titraties?
|
En verder....
Antwoord op bovenstaande vraag:
| methyloranje: | A | B | C | D | ||
| methylrood | A | B | D | E | F | |
| lakmoes | A | B | C | D | E | |
| broomthymolblauw | A | B | D | E | ||
| fenolftaleÏne | A | B | C | D | F |