Startpagina mlochemie
Excel en de ijklijn
Bij het maken van opgaven waarbij een ijklijn of "kalibratielijn" nodig is, kun je het best gebruik maken van een spreadsheet. Dit komt natuurlijk ook veel voor bij het practicum. Je zal in je opleiding hiermee al kennisgemaakt hebben. Mocht dat niet zo zijn of je wilt het nogeens van een ander horen, dan is hier wat info.
Je kunt Excel gebruiken om een beste rechte te krijgen door een reeks bij elkaar horende x- en y-waarden. Hierbij is de x-waarde de meest nauwkeurige. Bijvoorbeeld de concentratie. En de y-waarde de minder nauwkeurige, bijvoorbeeld de gemeten extinctie of de emissie-intensiteit. De beste rechte lijn is dan de rechte met de kleinste afwijkingen van de gemeten y-waarden. Omdat y-waarden positief of negatief kunnen afwijken gebruikt het programma de kwadraten van de afwijkingen. We noemen dit daarom de methode van kleinste kwadraten. Of 'lineaire regressie'.
Hieronder volgen enkele manieren om excel hierbij te gebruiken.
model 1
Lineaire regressie met Excel door middel van een grafiek. Zie onder de link de uitleg van het maken van een grafiek.
model 2
Lineaire regressie met Excel door middel van een de fucnties RICHTING en SNIJPUNT. Uitleg onder de link
model 3
Lineaire regressie met Excel door middel van de functie LIJNSCH. Uitleg weer onder de link.
Het voorbeeld spreadsheet kun je hier ook downloaden. De cellen hierin zijn niet beveiligd dus je kunt de boel gemakkelijk door elkaar gooien.
In het voorbeeld spreadsheet zijn 5 getallenparen gebruikt (5 x-waarden en 5 y-waarden). Gebruik je minder, bijvoorbeeld 4 getallenparen, dan moet je de functie in cel B9 opnieuw instellen. Gebruik je meer getallenparen, bijvoorbeeld 7 dan moet je de functies in de cellen B9, B13, B14 en B15 opnieuw instellen.
model 4
Het 4e voorbeeld gaat over standaard additie. Weer met de functie LIJNSCH. Ook hiervan kun je uitleg krijgen en ook een leeg voorbeeld spreadsheet downloaden. Hiervoor geldt ook: cellen niet beveiligd, dus je gooit de boel gemakkelijk door elkaar.
En ook hier: bij minder meetparen dan 5, dan moet je de functie in cel B11 opnieuw instellen. Bij meer meetparen dan moet je de functies van de cellen B11, B15, B16 en B17 opnieuw instellen.
Eelektroforese gaat over een scheidingstechniek die berust op verschillen in:
- ionlading
- deeltjesgrootte
We zetten een gelijkspanning op een waterige oplossing in poreus materiaal. Dat kan gewoon fitreerpapier zijn, maar meestal een gel (gelatine-achtige kunststof). Door dit poreus materiaal laten we het monster lopen. Het lijkt op vloeistofchromatografie maar dan met hulp van een elektrische spanning. Omdat veel moleculen, afhankelijk van de pH een lading hebben, vooral biomoleculen, helpt de spanning bij de scheiding. Het gaat hier vooral om : aminozuren, eiwitten, nucleïne zuren (DNA, RNA-fragmenten).
Aminozuren en eiwitten kunnen worden geconcentreerd op een plaats van de gel waar de pH gelijk is aan het IEP van de component. Het molecuul staat dan stil in het elektrisch veld.
DNA en RNA-fragmenten bewegen naar de + pool. Zij hebben immers negatief geladen fosfaatgroepen in het molecuul (bij niet heel lage pH).
Als je verder wilt kennismaken met elektroforese... dan zijn hier enkele geschikte linkjes:
Biorad demo van agarose gel DNA elektroforese
DNA elektroforese animatie
GeneAd PAG elektroforese
Capillair elektroforese
Bij de instrumentele uitvoering van elektroforese gebruik je een capillair. Een capillair van bijvoorbeeld 50 cm lengte staat met de uiteinden in een bufferoplossing. De monsteroplossing wordt onder druk aan één uiteinde ingebracht. Daarna wordt een hoge gelijkspanning (30000 V) op de uiteinden gezet. Door de hoge spanning is er een sterke "elektro-endosmose". Dat wil zeggen: de vloeistof in de capillair gaat zelf ook bewegen.
De capillair techniek wordt veel toegepast bij DNA-onderzoek.
Wil je er meer van weten: Wikipedia uitleg en / of DNA fingerprint uitleg van kennislink
"Hoge druk vloeistofchromatografie" zei men vroeger. Later is er "hoge prestatie vloeistofchromatografie" van gemaakt. HPLC lijkt op GC maar dan met vloeistof in plaats van gas. Stoffen die niet vluchtig te maken zijn, meestal omdat zij eerder ontleden dan verdampen, die kun je dus chromatograferen met HPLC. Het is ook goed te vergelijken met vloeistofchromatografie in een verticale glazen buis. Alleen hebben we de zwaartekracht vervangen door een sterke pomp. En de stationaire fase bestaat uit heel kleine korreltjes (0,003 - 0,010 mm). Deze kleine korreltjes vormen een zo dichte pakking dat de extra sterke pomp nodig is.
Uit welke onderdelen bestaat het HPLC-instrument? Bekijk de video.
Bij HPLC vind je meer scheidingsprincipes dan bij GC/GLC. Molecuulgrootte en ionenwisseling zijn hier ook belangrijk.
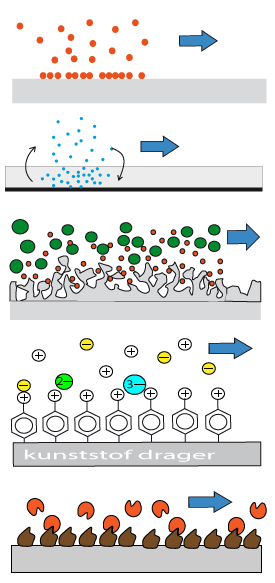 Adsorptie
Adsorptie
Langskomende moleculen worden aan het oppervlak geadsorbeerd.
Verdeling
Moleculen lossen op in de stationaire fase. Er stelt zich een evenwicht in tussen de concentratie in de stationaire en die in de mobiele fase.
Uitsluiting (exclusie)
Kleine moleculen worden tegengehouden door de holtes in de stationaire fase. Grote moleculen gaan ongehinderd door.
Ionenwisseling
Scheiding door lading: negatieve ionen houden de positieve vast en natuurlijk omgekeerd. Hoe hoger de lading des te sterker de remming.
Affiniteit
Stereospecifieke binding: moleculen passen precies op andere. Er wordt maar één type eiwit gebonden
Eluens
Verschillende oplosmiddelen kunnen worden gebruikt als mobiele fase. In het geval van adsorptie en verdelingschromatografie is de polariteit van groot belang. De mogelijke oplosmiddelen worden daarom weergegeven als een eluotrope reeks. Dat wil zeggen een reeks die stapsgewijze steeds sterker polair wordt. De reeks loopt van hexaan (apolair) tot methanol (polair) of zelfs water (zeer polair). De oplosmiddelen kunnen worden gemengd. Ook geleidelijk tijdens de elutie: gradiëntelutie.
- Het eluens moet vrij van deeltjes zijn en wordt daarom gefiltreerd (inlaat met filter).
- Het eluens moet vrij van opgeloste lucht zijn en wordt daarom tevoren ontgast.
Bij HPLC (adsorptie en verdeling) verdringt het eluens de componenten van de stationaire fase. Is het eluens minder polair dan de stationaire fase, dan noemen we dit "normal phase". Als stationaire fase gebruik je silica of een gebonden polaire fase zoals aminogroepen of OH-groepen. Is het eluens meer polair dan de stationaire fase dan is dit "reversed phase". De stationaire fase is dan een apolaire stof op de silicadrager (of kunststofdrager). De actieve groepen zijn C8, C18, phenyl of cyanogroepen.
Injector
De injectie van het monster gebeurt bij HPLC door een "sample loop". Dat wil zeggen: je schakelt een vast volume monstervloeistof in de lopende mobiele fase. Dit is steeds een even groot volume. Het voordeel is dat bij hplc externe standaarden mogelijk zijn. Je kunt dus een ijklijn (kalibratiecurve) maken voor een bepaalde component. Animatie sample loop.
Kolom
De kolom is bij HPLC een stevige stalen buis met hierin heel fijn verdeeld materiaal. De kolom is meestal niet langer dan 20 á 30 cm. Kolommen worden met de gewenste inhoud: korrelgrootte en stationaire fase, kant en klaar gekocht. Er zijn voor speciale doeleinden ook capillaire kolommen in gebruik. Kolommen worden steeds vaker in een oven of waterbad op temperatuur gehouden.
Detector
- UV De UV-detector is het meest gebruikt. Je meet dan dus de absorptie van de langskomende componenten. Het kan zijn dat je een component "niet ziet" doordat deze niet de gekozen golflengte absorbeert. Dan is de diode-array een oplossing.
- Diode-array Diode array werkt als de uv-detector maar meet in een groter deel van het spectrum.
- Brekingsindex Weinig gevoelig en bij gradiënt elutie niet bruikbaar.
- Fluorescentie Zeer gevoelig voor specifieke stofjes. Maar ja: voor andere stofjes dus minder.
- MS De massaspectrometer. Ook bij HPLC slagen de technici er in om een koppeling met de massaspectrometer tot stand te brengen. Dat is niet zo eenvoudig omdat je de monstercomponenten wilt analyseren en het oplosmiddel kwijt wilt raken. De MS werkt immers in vacuüm!
Veel routineanalyses worden gedaan met twee detectoren. Je kunt dan gebruik maken van specifieke gevoeligheid, bijvoorbeeld met fluorescentie, maar toch ook de andere componenten meten met bijvoorbeeld UV. Bovendien heb je een dubbele meting, wat de uitkomst meer zekerheid geeft.
Voorbeelden van stoffen die met HPLC gemeten worden:
- anorganische ionen
- organische kleurstoffen
- aminozuren
- eiwitten
- suikers
- vetzuren
Ook hier geldt weer: het is een specialisme, een vak apart. We gaan hier voor een ultra beknopte globale samenvatting. De rode begrippen in onderstaande afbeelding vormen de leidraad. Om een eenvoudige toepassing van gaschromatografie te zien, met uitleg in het Engels, ga je naar de volgende video.
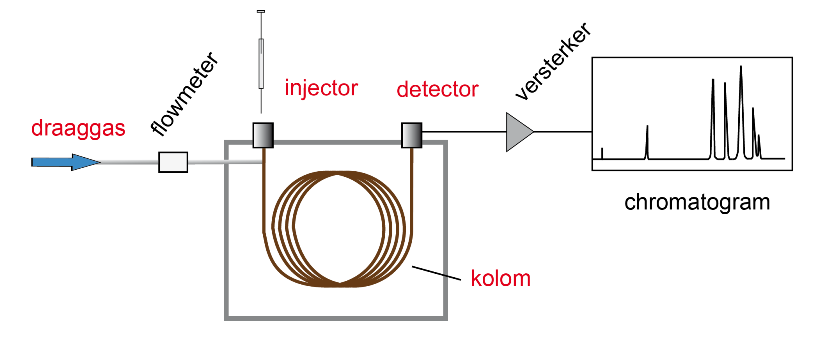
Draaggas
- He meest gebruikt.
- H2 ook heel geschikt, maar ja: wel erg brandbaar, nodig als "make up-gas" bij gebruik van de FID.
- N2 minder geschikt bij wat hogere gassnelheden.
Injector
- Standaardinjector. Verdampingsinjector, hoge temperatuur, zodat alle componenten als gas de kolom ingaan. Vooral bij gepakte kolom.
- Split. Niet voor heel lage concentraties. Verdampingsinjector. Kans op ontleden en discriminatie. Gebruikt voor capillaire kolom.
- Splitless. Voor capillaire kolom. Ook lage concentraties. Het monster condenseert op de koude kolom. Componenten worden nog geconcentreerd aan het begin van de kolom, doordat het vluchtige oplosmiddel langzaam verdampt en de componenten "opschuiven" zonder te verdampen (solvent trapping).
- Oncolumn. Voor hoge en lage concentraties. Injectie (als voeistof) op de koude kolom. Componenten worden nog geconcentreerd als bij splitless. De analyse start met het temperatuurprogramma.
Kolom
- Gepakt. Kan een grotere hoeveelheid monster verwerken. Tamelijk brede pieken, lage resolutie. Voor kwantitatief routine werk niet of nauwelijks toegepast, maar voor specifieke analyses nog wel. Bijvoorbeeld voor preparatief werk en als je de gescheiden componenten wil opvangen (in een sterk gekoeld buisje...).
- Capillair. Capillaire kolommen zijn het meest gebruikelijk voor kwantitatieve analyse. Beschikbaar in verschillende lengtes, diameters, stationaire fasen. Een gemiddeld polaire stationaire fase zal in de meeste gevallen het werk wel aan kunnen. Maar er zijn meer mogelijkheden: van polariteit 0 voor squalaan tot polariteit 100 voor polyethyleenglycol (PEG). Om een scheiding voor een gegeven mengsel te verbeteren kun je - in principe - kiezen: lange kolom, smallere kolom, andere stationaire fase.
Detector
- TCD Voor alle componenten, maar niet zo gevoelig. Ze blijven wel heel.
- FID De meest populaire detector. Zeer gevoelig. De component moet wel brandbaar zijn. Er is H2-gas nodig.
- ECD Extreem gevoelig voor elektronegatieve elementen (halogeen, N, O). Maar ja: voor andere elementen dus minder.
- MS De massaspectrometer. Droomdetector: gevoelig, algemeen toepasbaar en ideaal voor identificatie van componenten. Wel duurder dan de andere.
- Dit zijn de meest algemeen gebruikte. Voor specifieke toepassingen zijn nog verschillende andere detectoren mogelijk.
Berekeningen met de interne standaard: de relatieve gevoeligheidsfactor nader bekeken.