Startpagina mlochemie
Oxidimetrie gaat over 'redox-titraties'. Een redox-titratie is een titratie met elektronen. Er zit in de buret een oxidator (neemt elektronen op) of een reductor (staat elektronen af). In principe zijn er veel mogelijkheden om redoxtitraties uit te voeren. Maar in de praktijk valt het mee. Als je in de buret een sterke oxidator nodig hebt dan is KMnO4 (kaliumpermanganaat) een goede keuze. Heb je een sterke reductor nodig dan gebruik je meestal Na2S2O3 (natriumthiosulfaat). Zijn er speciale eisen dan dan zijn er andere reagentia: K2Cr2O7 (kaliumdichromaat) als oxidator, Ce(SO4)2 (ceriumsulfaat) als oxidator, FeSO4 (ijzer(II)sulfaat aangezuurd) als reductor enzovoorts.
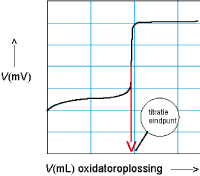
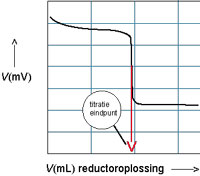
We hebben natuurlijk de mogelijkheid om het titratie-eindpunt op het oog te vinden, maar redoxtitraties worden vaak met potentiometrische meting uitgevoerd. Titreer je met kaliumpermanganaat (of een andere oxidator) dan stijgt de spanning, titreer met met een reductor dan daalt de spanning. Het eindpunt ligt daar waar de verandering het grootst is.
Zie afbeeldingen:
 |
 |
Chemische berekeningen bij titraties blijven lastig. Zeker als een titratie indirect verloopt en dan ook nog een terugtitratie is....
Daarom hieronder de uitwerking van opgave 14:
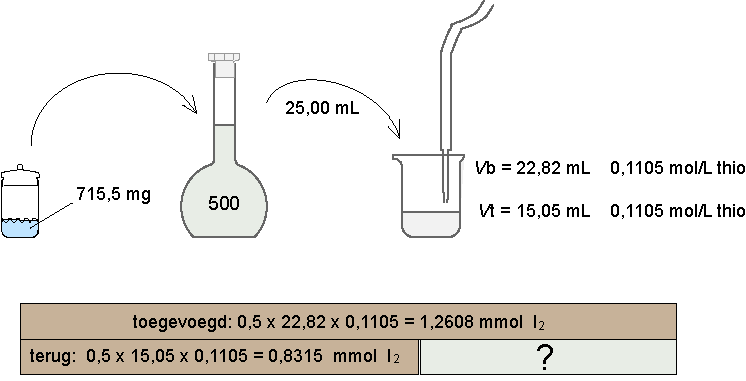
Op de plaats van het vraagteken moet dus staan: 1,2608 - 0,8315 = 0,4293 mmol I2. Dit heeft gereageerd met het methanal. Reactieverhouding I2 : CH2O = 1 : 1
Hoeveel mmol methanal zit dus in de 25,00 mL? Dus hoeveel mmol in de kolf van 500? Dus hoeveel mg in de inweeg? Dus hoeveel % methanal bevat de formaline?
En verder....
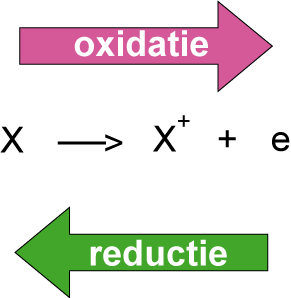
Bij oxidatie wordt het oxidatiegetal groter. De reductor geeft elektronen weg. De oxidatiereactie laat zien hoe de reductor geoxideerd wordt. Bij reductie wordt het oxidatiegetal kleiner. De oxidator neemt elektronen op. De reductiereactie laat zien hoe de oxidator gereduceerd wordt.
De spanningsreeks van metalen plaatst de metalen in volgorde van reactiviteit. Hoe onedeler het metaal des te reactiever, hoe edeler des te minder reactief. Niet om uit je hoofd te leren maar mocht je dat toch leuk vinden gebruik dan de ezelsbrug:
Karel, Carla en Nathan Mogen op Al Z’n Feestjes Snoepjes Proberen, Het Cussen Hoog Agter in de PostAuto.
Elk metaal (behalve de heel edele Au en Pt) kan worden geoxideerd, zie voor zink de animatie. Zet je verschillende metalen in waterige oplossingen dan onstaat een galvanische cel. Er is spanningsverschil tussen de verschillende metalen en je kunt zo een eenvoudige stroombron maken. Bijvoorbeeld met Cu en Zn. Zo worden ook batterijen en accu's gemaakt. Een batterij die je kunt opladen noemen we een 'accu'. Er zijn veel verschillende accu's voor verschillende toepassingen. Een overzicht zie je hier.
Hier volgt de oplossing van opgave 8a: Welke deeltjes worden geoxideerd, welke gereduceerd?
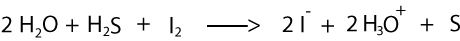
Je kijkt naar de oxidatiegetallen (H altijd +1, O altijd -2):
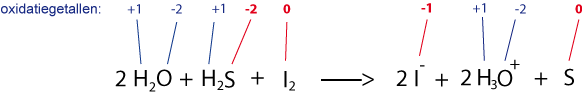
En dus: I2 gaat van 0 naar -1 dus wordt gereduceerd.
S2- gaat van -2 naar 0 dus wordt geoxideerd.
Docent Sieger Kooij legt het nog eens uit: redoxreacties en: halfreacties
En verder..
In een alkaan heeft elk C-atoom 4 bindingen. Elk C-atoom is het midden van een tetraëder. Ieder van deze bindingen is vrij draaibaar. Een molecuul kan daardoor allerlei ruimtelijke vormen aannemen zolang de bindingen niet verbroken worden. Hieronder: enkele willekeurge ruimtelijke toestanden van het butaan-molecuul.
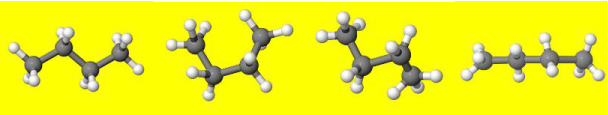
Enkele conformaties (willekeurige ruimtelijke toestanden) van butaan.
In een alkeen zijn ten minste 2 koolstofatomen aan elkaar gebonden met een dubbele binding. De dubbele binding is niet vrij draaibaar. Hierdoor zijn er twee moleculen: cis (zijgroepen naar elkaar toe) en trans (zijgroepen van elkaar af). Hieronder de twee configuraties van 2-buteen.
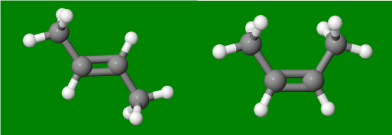
Trans-buteen en cis-buteen.
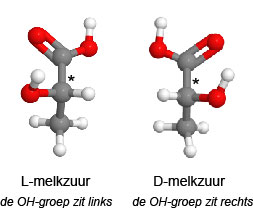
Dan hebben we nog spiegelbeeld isomerie: twee moleculen met dezelfde brutoformule maar ruimtelijk toch verschillend. Het voorbeeld uit paragraaf 16.7 hier nogmaals. Melkzuur (ethaanzuur) bestaat in 2 modellen: D-melkzuur, de OH-groep op het middelste atoom zit rechts (als de zuurgroep omhoog wijst). En L-melkzuur. Dan staat de OH-groep naar links (zuurgroep naar boven). Beide molecuulmodellen staan hieronder.
Bedenk dat elke binding (nou ja: behalve de dubbele) draaibaar is. Bedenk dat de -COOH en de -CH3 groepen daarom elke stand kunnen aannemen. Maar niet de OH-groep aan het middelste atoom!
Er zijn verschillende app's waarmee je moleculen kan tekenen en ruimtelijke structuren kan bekijken.
Redelijk eenvoudig is 'MolView' kijk maar eens op https://molview.com/
En verder ....
Maak je natuurlijk weer de eenvoudige test. En de wat moeilijkere test. Voor het leren van nieuwe woorden is het kruiswoordraadsel 16 weer nuttig!
Veel koolstofverbindingen komen uit aardolie. Destillatie van ruwe aardolie levert vooral alkanen.
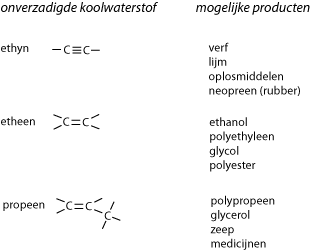
Onverzadigde koolwaterstoffen ontstaan vooral bij het kraken van aardolie.
De onverzadigde koolwaterstoffen worden gebruikt om veel andere nuttige producten van te maken, bijvoorbeeld:
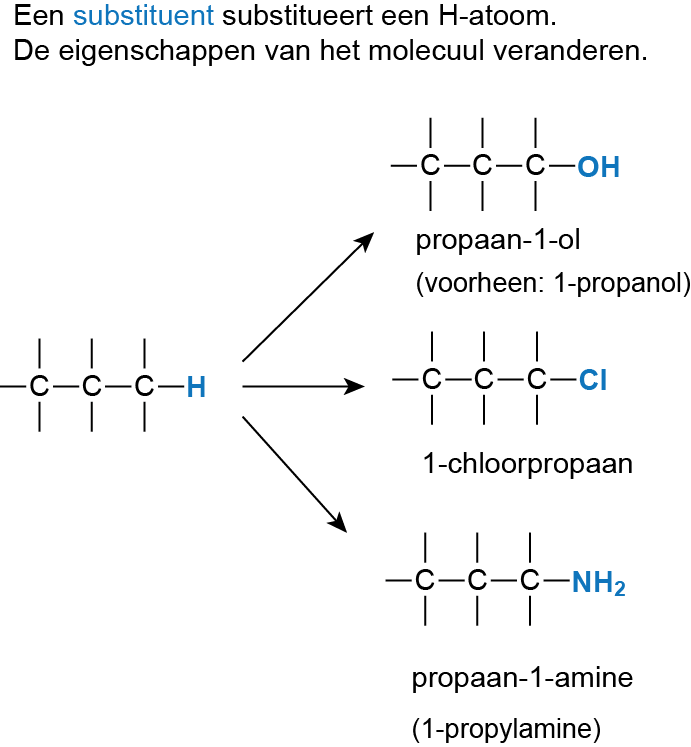
Een organisch molecuul van alleen maar Koolstofatomen en waterstofatomen is chemisch gezien een beetje saai. Het molecuul krijgt andere eigenschappen door een functionele groep. Functionele groepen worden in het molecuul gebracht door reactie met onverzadigde koolstofverbindingen.Een functionele groep kan een substituent zijn:
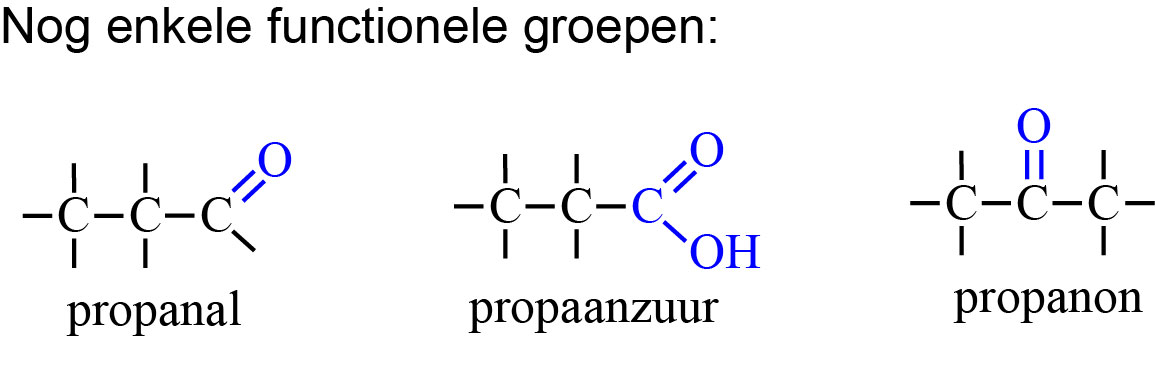
Een bepaalde functionele groep kan in veel verschillende moleculen voorkomen. Een eenvoudige rij van moleculen die alleen -CH2- van elkaar verschillen, noemen we een homologe reeks. Bijvoorbeeld de homologe reeks van de carbonzuren:
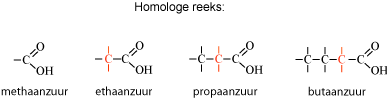
Het molecuul wordt steeds -CH2- groter.
Voor een laboratoriummedewerker is het natuurlijk van groot belang de namen van de stoffen goed te kennen.
Je gebruikt een gewone (triviale) naam of je gebruikt de systematische naam. Dan volg je de naamgevingsregels. Gelukkig heb je de belangrijkste naamgevingsregels voor de koolwaterstoffen al geleerd.... Over regel 3 uit hoofdstuk 15 nog het volgende: de plaats van de functionele groep wordt aangeven met een nummer. Dit nummer werd voor de naam geplaatst. De nieuwe regel is: direct voor de functionele groep-naam.
Dus:
1-propanol wordt: propaan-1-ol
2-pentanon wordt: pentaan-2-on
Maar: 1-chloorpropaan blijft: 1-chloorpropaan, het nummer staat dan al voor de naam van de substituent.
Butaanzuur blijft butaanzuur want een zuurgroep kan alleen maar eindstandig zijn (plaatsnummer: 1). Als het vanzelf spreekt dan laten we het nummer weg.
Oké, kun je nu zeggen hoe deze heet:
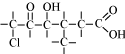
En verder....
Test jezelf of doe het kruiswoord..
De naam van bovenstaand stofje is natuurlijk: 6-chloor-4-hydroxy-3-methyl-5-oxo-hexaanzuur