Startpagina mlochemie
 Zuurstof is het element dat het meest op aarde voorkomt. Het is voor het leven op aarde heel belangrijk: zonder zuurstof geen leven. Zuurstof reageert gemakkelijk met heel veel stoffen. Geen wonder dat ook heel veel elementen verbindingen vormen met zuurstof. Dit zijn oxiden. Het bekendste voorbeeld is natuurlijk H2O. Water het oxide van waterstof. Een ander bekend voorbeeld is ijzerroest. IJzerroest ontstaat uit ijzer, zuurstof en water. Maar ..... roest is dan ook geen puur oxide maar een hydroxide. Om ijzerroest te maken moet ijzer wel eerst met zuurstof tot oxide reageren.
Zuurstof is het element dat het meest op aarde voorkomt. Het is voor het leven op aarde heel belangrijk: zonder zuurstof geen leven. Zuurstof reageert gemakkelijk met heel veel stoffen. Geen wonder dat ook heel veel elementen verbindingen vormen met zuurstof. Dit zijn oxiden. Het bekendste voorbeeld is natuurlijk H2O. Water het oxide van waterstof. Een ander bekend voorbeeld is ijzerroest. IJzerroest ontstaat uit ijzer, zuurstof en water. Maar ..... roest is dan ook geen puur oxide maar een hydroxide. Om ijzerroest te maken moet ijzer wel eerst met zuurstof tot oxide reageren.
Metalen geven basische oxiden. Dat wil zeggen dat met water een hydroxide kan ontstaan. Hydroxides geven OH- ionen af. Een hydroxide is een "base". Vandaar de naam "basische oxiden".
Verschillende metaal-oxiden vervullen in ons dagelijks leven een belangrijke rol. Neem calciumoxide: CaO. Calciumoxide is een wit poeder bekend als "ongebluste kalk". Het is een belangrijke grondstof voor bouwmaterialen als kalkzandsteen en metselspecie.
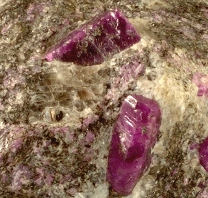
Een bijzonder oxide is aluminiumoxide. Aluminium wordt gemakkelijk geoxideerd door de luchtzuurstof. Maar het oxide vormt een afsluitend laagje op het aluminium. Het roest dus niet verder. Dat Al2O3 een heel stabiel oxide is, blijkt ook uit het feit dat er veel (half) edelstenen zijn die voornamelijk uit aluminiumoxide bestaan. Bijvoorbeeld robijn (foto rechts). De rode kleur komt doordat er ook chroomionen in zitten.
Aluminiumoxide wordt ook veel gebruikt als slijpmiddel, slijpschijven, schuurpapier, ed.
De namen (volgens de regels) zijn eenvoudig: calciumoxide, aluminiumoxide, natriumoxide enzovoorts. Maar... let op! Als er meer soorten oxiden van één metaal zijn, dan noemen we de ion-waardigheid in de naam. Bijvoorbeeld: IJzer(III)oxide voor Fe2O3 en IJzer(II)oxide voor FeO.
Niet-metalen worden geoxideerd tot "zure oxiden". Met water geven zij zuren. Dit geldt bijvoorbeeld voor de oxiden van P, S, en N. Maar niet alle niet-metaaloxiden geven zuren met water.
Heel belangrijke oxiden van niet-metalen: Waterstofoxide: H2O Water is natuurlijk het belangrijkste oxide dat we hebben. Waterstofoxide geeft met water geen zuur.
Koolstofdioxide: CO2 Onzichtbaar gas maar maar wel heel belangrijk: bubbels in het bier en tafelwater. Broeikasgas. Reactieproduct van de meeste verbrandingsprocessen. Koolstofdioxide geeft met water geen stabiel zuur. Het "koolzuur" valt meteen na zijn ontstaan weer uit elkaar in water en CO2.
Siliciumdioxide: SiO2 dat wil zeggen: zand. Belangrijke grondstof voor glas, steen, metselspecie, beton en ga zo maar door. Ook zand geeft met water geen zuur, zoals je wel moet weten als je wel eens aan het strand komt.
Voor de namen van de niet-metaaloxiden gebruiken we andere regels. Het aantal atomen in het molecuul wordt steeds genoemd: P2O5 wordt: difosforpentaoxide.
In het dagelijks leven worden de namen vaak versimpeld: monokoolstofdioxide wordt dan: kooldioxide.
En verder.....
Namen en reacties (boek!) uit je hoofd leren en de test maken: test hoofdstuk 9, kruiswoord 9. test hoofdstuk 9 n4
Atomen, ionen en moleculen reageren als deeltjes. Daarom rekenen we met deeltjes. Met hoeveelheid stof in mol.
1 mol = 6,022 x 1023 deeltjes
molaire massa = hoeveelheid in gram die 1 mol deeltjes bevat
Voorbeeld: 1 mol ijzer weegt 55,84 gram en bestaat uit 6,022 x 1023 ijzeratomen.
De mol in reacties
We maken het niet moeilijker dan het is:

Wat je bij het rekenen nodig hebt:
* kloppende reactievergelijking
* molaire massa's van de reagerende stoffen
De berekening gaat als volgt:

Van de volgende beweringen is er één fout, welke is dat?
a Tijdens een reactie blijft de massa gelijk.
b Tijdens een reactie blijft het aantal deeltjes gelijk.
c Tijdens een reactie veranderen de deeltjes van samenstelling.
De docent legt het nog eens uit: de mol
En verder...
test Hoofdstuk 8, test hoofdstuk 8 n4
Van de drie beweringen hierboven is de foute bewering: b.
Naamgeving
Eerst nog even over de namen van anorganische stoffen. Voor de systematische naamgeving zijn de regels iets veranderd. De verandering staat nog niet in het boek omdat nog niet duidelijk is of het in de praktijk gebruikt zal worden. De bestaande namen blijven namelijk gewoon toegestaan en de nieuwe zijn lastiger in gebruik. Voor meer informatie: BINAS tabel 66G of klik hier.
Molecuulformules
Je kunt op verschillende manieren laten zien hoe een molecuul opgebouwd is. We hebben een 'molecuulformule', een 'elektronenformule' enzovoort. Als eenvoudig voorbeeld het watermolecuul:

Hoe zijn atomen aan elkaar gehecht?
Twee atomen kunnen - in hoofdzaak - op 2 manieren aan elkaar gebonden zijn:
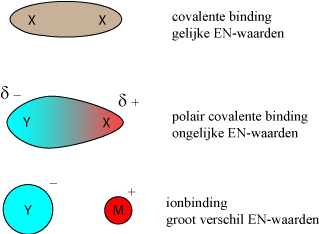
Covalent Twee atomen delen een aantal elektronen: zij hebben dan een "bindend, gemeenschappelijk, elektronen paar".
Ionen Het ene atoom geeft een (of twee) elektronen aan het andere atoom, er ontstaan ionen die (aantrekking + en -) bij elkaar blijven.
In beide gevallen heeft het atoom een octed (8-omhulling van elektronen). We noemen dit: edelgasconfiguratie.
Covalent
Bijvoorbeeld de binding tussen twee chlooratomen, of de binding tussen twee zuurstofatomen:
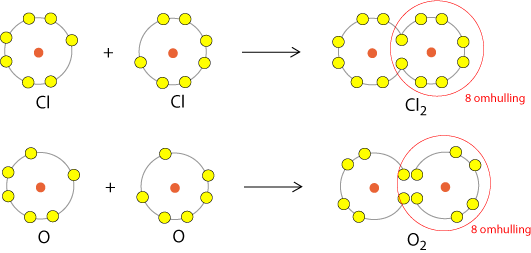
Chlooratomen vormen moleculen. Beide atomen in een molecuul delen een elektron met de ander. Zo heeft ieder atoom een octed (8-omhulling) aan elektronen. Zo is dat ook bij zuurstof. Nu delen de zuurstofatomen ieder 2 elektronen met de ander. Zo komen beide elementen (chloor en zuurstof) aan een stabiele toestand: de edelgasconfiguratie (8 elektronen in de buitenste schil).
Ionen
Atomen kunnen ook eenvoudig een elektron weggeven of krijgen en daardoor 8 omhulling bereiken. Als een atoom een elektron weggeeft wordt dat atoom een + ion. Het atoom dat het elektron ontvangt wordt een - ion.

Een atoom kan dus 8-omhulling krijgen door zich covalent te binden aan een zelfde soort atoom of door een elektron af te staan/op te nemen van een heel ander atoom. Tussen de uitersten: covalent of ionbinding, kan het atoom ook een polair covalente binding aangaan. De atomen delen dan wel hun bindende elektronen maar zij worden niet ion. Zo zijn heel veel covalente bindingen polair. Als twee atomen dezelfde EN-waarde hebben dan is de binding zuiver covalent. Hebben twee atomen een verschil in EN-waarde van groter dan 2, dan zal er eerder een ionbinding ontstaan. Is er wel verschil in EN-waarde maar niet zo groot, dan is de binding polair. (Voor EN-waarden zie het periodiek systeem.):
Heeft een stof polaire moleculen dan klitten de moleculen sterker aan elkaar. De stof heeft dan een hoger kookpunt dan zonder die polariteit. Zijn er ook nog H-bruggen zoals in water dan klitten de moleculen nog sterker aan elkaar. In water bewegen de moleculen willekeurig door elkaar. (Linker afbeelding hieronder). De moleculen hebben af en toe één of meer H-bruggen. In ijs hebben de watermoleculen ieder 4 H-bruggen en is er een vaste kristalstructuur (Rechter afbeelding hieronder).

Speelse animaties om een en ander te verduidelijken: vorm van het molecuul en dipoolmolecuul.
En verder..
En nog verder ....
Een binding heeft een elektronenpaar tussen de atomen. Veel moleculen hebben dubbele bindingen tussen twee atomen.
Hoe moeten we ons dat voorstellen?
Chemisch rekenen met mol is lastig. Vooral met de concentratie in mol/L. Maar... neem de moeite om het 'probleem' goed op papier te zetten, met een tekening. Dan wordt de probleemstelling pas duidelijk. Goed voorbereiden is hier het halve werk. Je kunt pas beginnen met oplossen als je begrijpt wat er gevraagd wordt. Als voorbeeld enkele uitwerkingen van vragen uit het boek.
Opgave 2 b:
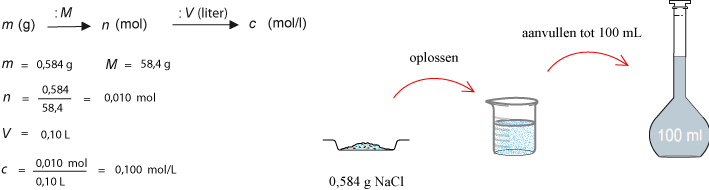
Opgave 18:

Opgave 20:

En verder.......
Zul je het toch zelf moeten doen..... Chemisch rekenen is een van de moeilijkere onderwerpen maar oefening helpt echt!