Startpagina mlochemie
Nog even de definities:
1 u = atomaire massa eenheid = 1/12 e deel van een C-12 atoom.
1 proton weegt: 1,673 x 10-24 gram of: 1,007 u
1 neutron weegt: 1,675 x 10-24 gram of: 1,009 u
1 elektron weegt: 0,00091 x 10-24 gram of: 0,00055 u
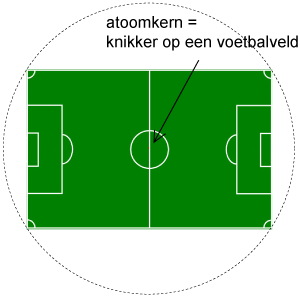
Het elektron weegt maar ongeveer 5/10000 e deel van een proton of neutron. De massa van het elektron telt bijna niet mee in de atoommassa. Dus bijna al de massa van een atoom zit in de kern. Deze kern is heel klein. In verhouding: zo klein als een knikker op de middenstip van een voetbalveld!
En verder...
hebben we nog een testje.
Elk atoom bestaat uit: neutronen, protonen en elektronen. Atomen van één element hebben allemaal hetzelfde aantal protonen. In een neutraal atoom is het aantal elektronen altijd gelijk aan het aantal protonen. Er zijn 92 elementen in de natuur. Er zijn nog circa 25 in een laboratorium gemaakt, deze zijn niet stabiel. Deze atomen vallen weer uit elkaar.
De eerste 10 atomen zien er dan als volgt uit:
In werkelijkheid zijn de protonen en neutronen in verhouding vééél kleiner dan hier getekend. Als het atoom zo groot zou zijn als een voetbalstadion dan is de kern van het atoom niet groter dan een knikker op de middenstip..... In werkelijkheid is het elektron ook niet een negatief deeltje dat rond draait maar eerder een negatieve ladingswolk rond de kern.
Wat is een isotoop?
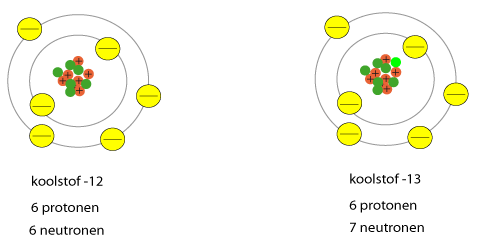
Twee atomen zijn isotopen van elkaar als de een meer neutronen heeft dan de ander. Het aantal protonen is gelijk. Ze horen dus bij het zelfde element! Bijvoorbeeld het koolstofatoom, het koolstofatoom heeft 6 protonen. Het meest voorkomende koolstof-isotoop heeft 6 neutronen. Het massagetal is 12. Maar ... 1 op de 100 koolstofatomen heeft 7 neutronen. Dat isotoop heeft dus een massagetal van 13!
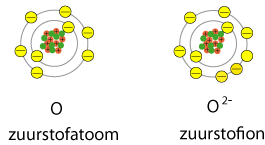
Wat is een ion?
Een atoom wordt ion als hij één of meer elektronen opneemt of afstaat. Bij opnemen krijg je een negatief ion, er komt negatieve lading bij. Bij het afstaan van elektronen ontstaat een positief ion, er gaat negatieve lading weg.
De atomen worden in het periodiek systeem geplaatst in de volgorde van het aantal protonen. Steeds als de buitenste hoofdschil vol is (volgens Pauli: 2n2) begint een nieuwe periode (rij). In de menubalk boven deze pagina staat een periodiek systeem met de (voor chemici) meest belangrijke informatie: atoommassa, atoomnummer, EN-waarde (hoofdstuk 7) en verdeling valentie elektronen over de subschillen. Er zijn ook uitvoeringen van het periodiek systeem met veel meer informatie... bij voorbeeld deze.
Doe een test of maak als oefening zelf je atomen
De docent legt het nog eens uit: atoombouw
De docent legt het nog eens uit: het periodiek systeem
Het periodiek systeem in video's.
En verder...
Zijn er weer de testjes: test hoofdstuk 5 en test hoofdstuk 5 n4. Interessant zijn zeker de eigenschappen van alkalimetalen uit de eerste groep van het PS. Ook leuk: elementsong.
 En dan nog even de subschillen.
En dan nog even de subschillen.
"Moeilijk" zeggen velen. Valt wel mee, meer een kwestie van wennen!
Laten we eens kijken naar 5-7 opgave 14 en dan het atoom chloor. Chloor-17 heeft 17 protonen en het neutrale atoom ook 17 elektronen. Voor de verdeling van de elektronen over de subschillen gebruiken we het energieschema en de tabel in 5-7. Begin van onderaf: elke s-schil krijgt 2 elektronen. De p-schil maximaal 6. Je komt uit in de 3e hoofdschil. Er zijn hier 7 elektronen. 2 in de 3 s, 5 in de 3p. Elektronenconfiguratie in de hoofdschil: 3s2 3p5. Je kunt dit terugvinden in het periodiek systeem. Hier kun je dus ook je andere antwoorden op vraag 14 controleren!
Vuurwerk!
Als je een vuurpijl afschiet dan zie je na de knal verschillende kleuren. Dit zijn verschillende metaalatomen die in zoutvorm in het vuurwerk zitten.
Een atoom kan licht uitzenden doordat een of meer elektronen in het atoom naar een "lagere schil" verhuizen. Dat zit zo: door de hoge temperatuur neemt een elektron energie op en verhuist naar een verder gelegen schil. De toestand is niet stabiel en het elektron valt terug naar zijn schil van de grondtoestand. Het elektron verliest nu zijn extra energie door een elektromagnetische golf uit te zenden, meestal zichtbaar licht. Bij elke elektronenovergang hoort een eigen golflengte en kleur.
In het voorbeeld: druk op de groene start-pijl en het elektron valt van en 4p-schil terug naar 4-s. De energierijke toestand van het atoom noemen we de "aangeslagen toestand".
Massaconcentratie is massa opgeloste stof per volume-eenheid. In formule: 
ρ(B) massaconcentratie stof "B" (g/L, mg/L, mg/mL enz.)
m (B) massa stof "B" (g, mg)
V volume oplossing (L, mL)
Voorbeeld
We lossen 500 mg stof op tot 250 mL en maken een verdunning van 10 mL in een kolf van 100 mL:

rekenwijze 1: met hoeveelheid
Ziet er bewerkelijk uit maar het valt wel mee: je zet steeds kleine stapjes met hoeveelheid stof.
* de eerste oplossing bevat 500 mg stof
* in 1 mL is dat: 500 mg / 250 mL = 2 mg
* we nemen 10 mL dus daarin zit: 10 x 2 = 20 mg
* deze 20 mg komt in het totale volume van 100 mL, dat is 0,10 liter
* de nieuwe concentratie wordt dus: ρ = 20 mg / 0,10 L = 200 mg/L
rekenwijze 2: met concentratie
Deze rekenwijze werkt sneller maar je moet goed met verhoudingen kunnen rekenen, je berekent eerst de concentratie en dan verdun je deze.
* de eerste oplossing bevat 500 mg in 250 mL, dat is 0,25 L
* de concentratie is dus: ρ = 500 mg / 0,250 L = 2000 mg/L
* de oplossing wordt verdund van 10 naar 100 mL, verdunningsfactor: 10 x. Dat wil zeggen: de concentratie wordt 10 x zo klein.
* nieuwe concentratie: 2000 mg/L / 10 = 200 mg/L
En verder..Maak je natuurlijk de test hoofdstuk 4 en misschien ook de test op niveau 4. Deze is niet eenvoudig. Hieronder wordt opgave 16 uit deze test nog even voorgedaan.
Opgave 16 test hoofdstuk 4 n4:
We maken 2,50 liter verdund salpeterzuur met 0,10 % HNO3, dichtheid 1,00 g/mL.
We gaan uit van een voorraadoplossing met 65,5 %(m/m) HNO3 dichtheid: 1,40 g/mL. Hoeveel ml van de voorraad moeten we verdunnen tot 2,50 L?
Verstandig om even een schets te maken:

Tijdens het verdunnen voeg je water toe. De hoeveelheid HNO3 die opgelost is, verandert niet. Dus: begin en eindoplossing bevatten evenveel HNO3.
0,10% van 2500 g is: 2,50 g HNO3. Zoveel zit ook in V mL voorraadoplossing. Dus: V x 1,40 x 0,655 = 2,5 Bereken V: 2,73 mL.
V x 1,40 x 0,655 = 2,5 want:
V mL
V x 1,40 g oplossing
V x 1,40 x 65,5 % g opgeloste stof (HNO3)
Met een fysische scheiding kun je mengsels scheiden in zuivere stoffen. De zuivere stoffen op hun beurt kun je chemisch splitsen:
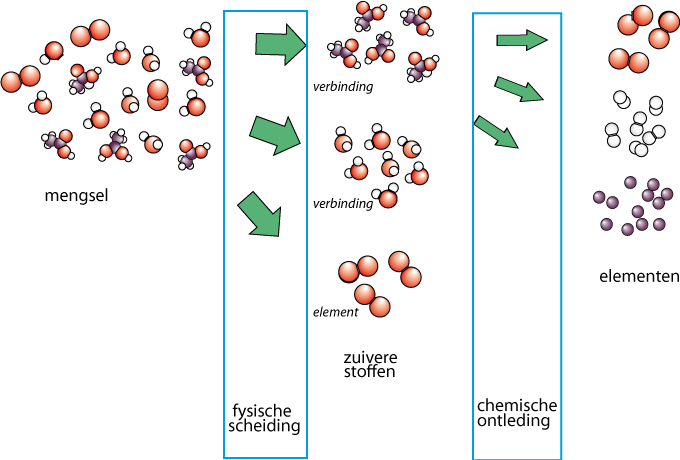
Mengsel: Verschillende stoffen door elkaar. Kunnen van elkaar gescheiden worden.
Verbinding: Zuivere stof. Kan alleen nog chemisch ontleed worden in elementen. Bestaat uit verschillende soorten atomen.
Element: Zuivere stof die niet verder ontleed kan worden. Bestaat uit één soort atomen.
Het verschil tussen een fysische scheiding of chemische ontleding is dus dat je bij een chemische ontleding de moleculen stuk maakt. Er ontstaan nieuwe stoffen.
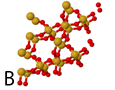
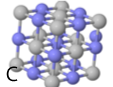
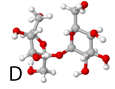
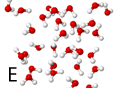
Hieronder staan 6 afbeeldingen. Modellen van kristallen, atomen of moleculen.
Het gaat om:
1 de verbinding sucrose (suiker)
2 de verbinding waterstofoxide (water)
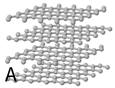
3 het element koolstof (grafiet)
4 de verbinding natriumchloride (keukenzout)
5 het element zuurstof
6 de verbinding siliciumoxide (kwarts)
|
|
 |
 |
 |
 |
 |
Het wordt natuurlijk wel tijd dat je de elementsymbolen uit je hoofd kent. Laten we zeggen die uit de tabel in paragraaf 3-2. Misschien helpt de volgende oefening?
Het kleinste filmpje ooit gemaakt is van IBM. Daar hebben ze met een naaldmicroscoop atomen en moleculen "zichtbaar" gemaakt. Door de moleculen één voor één te verplaatsen is er een poppetje van gemaakt. Vervolgens zijn de afbeeldingen (frames) gekoppeld tot een filmpje waarin het poppetje met een atoom speelt.... A boy and his atoom.
En verder...
Maak je natuurlijk de tests: test hoofdstuk 3 en test hoofdstuk 3 n4. Ook is er nog het kruiswoordraadsel.
oplossing van de vraag: A-3, B-6, C-4, D-1, E-2, F-5
Koolstof
Het element koolstof komt veel voor als grafiet. Grafiet bestaat uit plaatjes van koolstofatomen. Deze atomen zijn met ieder 3 bindingen stevig aan elkaar gebonden. Maar de plaatjes zijn zwak aan elkaar verbonden. De plaatjes schuiven daardoor gemakkelijk over elkaar. Grafiet wordt daarom wel gebruikt als smeermiddel.