Startpagina mlochemie
Een zout bestaat uit ionen. Metaalionen en "zuurrest-ionen". In de natuur komen zeer veel zouten voor. De meeste daarvan zijn niet - of heel slecht - oplosbaar. Denk maar aan de aardkorst. Hierin vinden we veel silicaten zoals in graniet, sulfaten zoals in gips en carbonaten zoals in marmer.
 De zouten die belangrijk zijn in het laboratorium lossen meestal wel goed op. Tijdens het oplossen worden de ionen gehydrateerd: zij krijgen een watermantel.
De zouten die belangrijk zijn in het laboratorium lossen meestal wel goed op. Tijdens het oplossen worden de ionen gehydrateerd: zij krijgen een watermantel.
Zouten kunnen op verschillende manier gemaakt worden.
Maar hoe groot zijn die verschillen eigenlijk. Zoek de verschillen:
SO3 + K2O → K2SO4
H2SO4 + K2O → K2SO4 + H2O
SO3 + 2 KOH → K2SO4 + H2O
H2SO4 + KOH → K2SO4 + 2 H2O
Je ziet: er staat steeds bijna hetzelfde. Een zout ontstaat uit een zuur en een hydroxide. En als je het water uit de stoffen verwijdert dan wordt dat: een zout ontstaat uit een zuur oxide en een basisch oxide...
Simpele oplosbaarheidsregels:
1 goed oplosbaar: K+, Na+, NH4+ en de zouten van NO3-
2 goed oplosbaar: Cl-, Br-, I-, SO42- behalve van: Ag+, Hg+, Pb2+, Ba2+, Ca2+,
3 slecht oplosbaar zijn zouten van: F-, SO32-, CO32-, S2-, PO43-, CN-, SiO32-, OH-.
voor meer details kijk je in de oplosbaarheidstabel in je boek of Binas. Voor nog meer info kijk je - voor oplosbaarheid in gram per 100 ml van heel veel zouten- in de wikipedia solubility table!
De docent legt het nog eens uit: ionen en zouten-1 en zouten-2
En verder.....
Kun je hier nog eens zien hoe zouten oplossen en ook weer neerslaan.





|
Zure stoffen ...
* zijn altijd goed oplosbaar in water,
* geven H+ aan het water,
* reageren met onedele metalen als Fe of Zn,
* reageren met marmer en andere steensoorten,
* lossen langzaam het glazuur van je tanden op.
|
Basische stoffen ...
* geven OH- in water,
* neutraliseren zuren,
* lossen (langzaam) koolhydraten op,
* lossen eiwitten op (glad gevoel aan je vingers!),
* tasten verf en laklagen langzaam aan.
|

De pH-schaal nog eens verduidelijkt met een animatie.
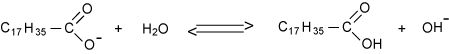
Koolzuur
Zeep

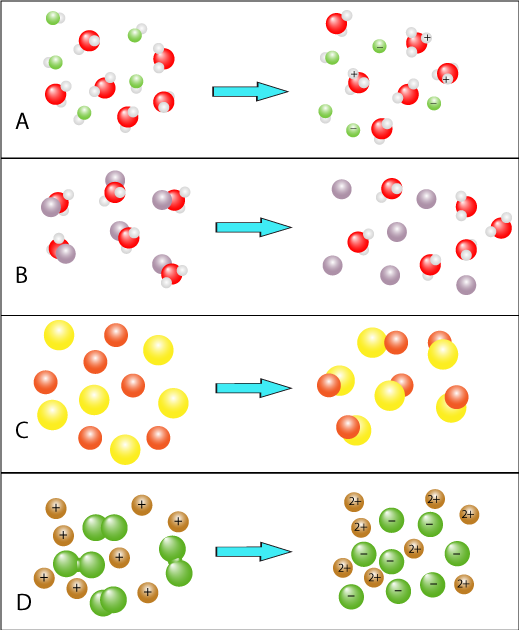
- Aard van de stoffen, de ene stof reageert sneller dan de andere. Ook al gaat het om het zelfde type reactie. Denk maar aan de reactie met water van de metalen Li-Na-Rb-Cs deze reactie verloopt steeds sneller.
- Temperatuur: hoe hoger de temperatuur des te sneller de reactie. Een vuistregel: 10 graden warmer is 2,5 maal sneller.
- Verdeling van (vaste) stof. Een ijzeren spijker brandt niet. Maar ijzerpoeder is wel brandbaar. Fijn verdeelde stoffen kunnen zelfs exploderen met luchtzuurstof. Stofexplosie
- Soms kan een katalysator helpen.
- Inwerking van licht
- Concentratie